题目内容
有一在空气中暴露过的KOH固体,含H2O 2.8%(质量分数,下同),含K2CO3 7.2%。取1 g该样品投入到25 mL 2 mol·L-1盐酸中,中和多余的盐酸又用去1.07 mol·L-1的KOH溶液30.08 mL,蒸发中和后的溶液,所得固体的质量为( )
| A.3.73 g | B.4.00 g | C.4.50 g | D.7.45 g |
A
此题数据较多,我们不要掉入数字陷阱之中,因为最后所得固体为KCl,其物质的量应等于盐酸中HCl的物质的量即2 mol·L-1×25×10-3 L="0.05" mol,m(KCl)="74.5" g·mol-1×0.05 mol="3.73" g。

练习册系列答案
相关题目
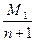 ∶
∶
 ∶
∶
