题目内容
(2011?漳州一模)氯化铍是用于制有机铍化合物和金属铍的重要原料.
(1)Be原子的基态价电子排布式为
(2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是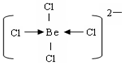
 .
.
(1)Be原子的基态价电子排布式为
2s2
2s2
,其元素的第一电离能>
>
B元素(填“>”或“<”或“=”),原因是Be的2s轨道全充满,体系能量低
Be的2s轨道全充满,体系能量低
.(2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为
分子晶体
分子晶体
; BeCl2中Be原子的杂化轨道类型是sp
sp
.(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是
共价键、配位键
共价键、配位键
,阴离子的结构式为

分析:(1)根据核外电子排布规律书写Be原子的基态价电子排布式;Be的2s轨道为全充满稳定状态.
(2)根据晶体的性质判断晶体类型;BeCl2中Be原子的杂化轨道数为2.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.
(2)根据晶体的性质判断晶体类型;BeCl2中Be原子的杂化轨道数为2.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.
解答:解:(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低.
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式.
故答案为:分子晶体; sp.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为.
故答案为:共价键、配位键; .
.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低.
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式.
故答案为:分子晶体; sp.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为.
故答案为:共价键、配位键;
 .
.点评:考查核外电子排布规律、元素周期律、晶体结构与化学键等,难度不大,注意基础知识的掌握.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目