题目内容
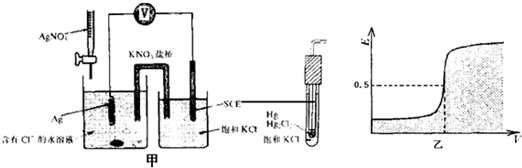
(2013?绍兴二模)电化学的应用非常广泛,可以利用电化学方法测定AgCl的溶度积,图甲就是测定AgCl溶度积装置,其原理是通过不断滴加硝酸银溶液,利用溶液中c(Ag+)大小会引起电位的变化进行测定的,加入硝酸银溶液的体积与电位(E)的关系图如图乙所示.
已知硝酸银溶液滴定过程中存在关系:E=0.8+0.0592lgc(Ag+) lg(8.5×10-6)=-5.07 Hg2Cl2为弱电解质.
下列说法不正确的是( )

已知硝酸银溶液滴定过程中存在关系:E=0.8+0.0592lgc(Ag+) lg(8.5×10-6)=-5.07 Hg2Cl2为弱电解质.
下列说法不正确的是( )
分析:甲为原电池装置,因Hg比Ag活泼,则SCE电极为原电池的负极,发生氧化反应,电极反应式为2Hg-2e-+2Cl-=Hg2Cl2,Ag极为原电池的正极,发生还原反应,电极方程式为Ag++e-=Ag,原电池工作时,阳离子向正极移动,阴离子向负极移动;根据电位计算公式可计算溶液中阴离子浓度.
解答:解:A.SCE电极为原电池的负极,发生氧化反应,电极反应式为2Hg-2e-+2Cl-=Hg2Cl2,故A正确;
B.SCE电极为原电池的负极,Ag极为原电池的正极,原电池工作时,阳离子向正极移动,阴离子向负极移动,故B正确;
C.电位突变时,溶液中阴离子浓度较大,可生成AgCl沉淀,此时有0.5=0.8+0.0592lgc(Ag+),解得c(Ag+)=8.5×10-6mol/L,AgCl的溶度积要小于8.5×10-6,故C错误;
D.甲为原电池装置,化学能转变为电能,故D正确.
故选C.
B.SCE电极为原电池的负极,Ag极为原电池的正极,原电池工作时,阳离子向正极移动,阴离子向负极移动,故B正确;
C.电位突变时,溶液中阴离子浓度较大,可生成AgCl沉淀,此时有0.5=0.8+0.0592lgc(Ag+),解得c(Ag+)=8.5×10-6mol/L,AgCl的溶度积要小于8.5×10-6,故C错误;
D.甲为原电池装置,化学能转变为电能,故D正确.
故选C.
点评:本题综合考查原电池知识,题目难度中等,注意把握原电池的工作原理,能正确书写电极方程式,为解答的关键,答题时要注意审题.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目