题目内容
11.为方便某些计算,有人将98%的浓硫酸表示成下列形式,其中合理的是( )| A. | H2SO4•H2O | B. | H2SO4•SO3 | C. | H2SO4•$\frac{1}{9}$H2O | D. | SO3•$\frac{10}{9}$H2O |
分析 假设98%的浓硫酸溶液质量为100g,则硫酸质量为100g×98%=98g,水的质量=100g-98g=2g,n(H2SO4)=$\frac{98g}{98g/mol}$=1mol,n(H2O)=$\frac{2g}{18g/mol}$=$\frac{1}{9}$mol;
如果将物质转化为三氧化硫和水,
n(SO3)=n(H2SO4)=1mol,m(SO3)=80g/mol×1mol=80g,n(H2O)=$\frac{100g-80g}{18g/mol}$=$\frac{10}{9}$mol,
根据N=nNA知物质的量之比等于其分子个数之比,据此分析解答.
解答 解:假设98%的浓硫酸溶液质量为100g,则硫酸质量为100g×98%=98g,水的质量=100g-98g=2g,n(H2SO4)=$\frac{98g}{98g/mol}$=1mol,n(H2O)=$\frac{2g}{18g/mol}$=$\frac{1}{9}$mol,根据N=nNA知物质的量之比等于其分子个数之比,所以N(H2SO4):N(H2O)=1mol:$\frac{1}{9}$mol=1:$\frac{1}{9}$,所以其化学式为H2SO4•$\frac{1}{9}$H2O,
n(SO3)=n(H2SO4)=1mol,m(SO3)=80g/mol×1mol=80g,n(H2O)=$\frac{100g-80g}{18g/mol}$=$\frac{10}{9}$mol,
N(SO3):N(H2O)=1mol:$\frac{10}{9}$mol=1:$\frac{10}{9}$,所以其化学式为SO3•$\frac{10}{9}$H2O,
故选CD.
点评 本题以浓硫酸为载体考查物质的量的有关计算,侧重考查分析计算能力,明确物质的量之比等于分子数之比是解本题关键,题目难度不大.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
| A. | ①②⑥ | B. | ②③⑥ | C. | ①③④⑤ | D. | 全部 |
| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
| A. | NO可以是某些含低价氮物质的氧化产物 | |
| B. | NO可以是某些含高价氮物质的还原产物 | |
| C. | 已知亚硝酸钠的化学式是NaNO2,则NO不是亚硝酸酐 | |
| D. | NO2和NO都是红棕色气体 |
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
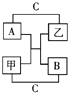 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.