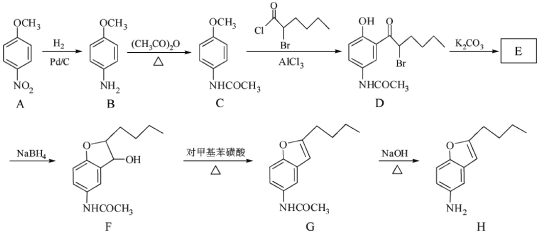
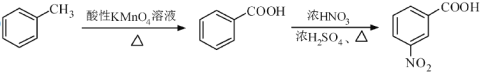
题目内容
【题目】含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是________.
A.S2- B.S C.SO32- D.SO42-
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。所选试剂是_______,该反应的离子方程式为 .
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面___________,则发生了钝化;若铁棒表面_____________,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式
最佳途径是_______(填序号),理由是
【答案】(1)D;(2)溴水;SO32-+Br2+H2O=2H++SO42-+2Br-;(3)无明显现象(填“无现象”也可) 有紫红色物质析出;(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;②;原料利用率高,环境污染小。
【解析】
试题解析:(1)酸性高锰酸钾具有强氧化性,SO2以还原性为主,两者发生氧化还原反应,+4价S→+6价,即选项D正确;(2)证明Na2SO3具有还原性,要有明显的现象说明,溴水具有强氧化性,溴水褪色,说明亚硫酸具有还原性,发生:SO32-+Br2+H2O=2H++SO42-+2Br-;(3)如果发生钝化反应,在铁表面产生铁的氧化物,铁的氧化物不与CuSO4反应,故无现象,如果铁和浓硫酸不反应,利用铁的金属性强于铜,在铁棒表面产生红色物质;(4)NO3-在H+条件现具有强氧化性,其离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;途径①有NO生成,对环境有污染,途径②发生的离子反应:2Cu+O2+4H+=2Cu2++2H2O,无污染,原料利用率高,途径③铜和只跟浓硫酸反应,随着反应的进行,反应将会停止,同时此反应产生SO2,对环境有污染。

 口算能手系列答案
口算能手系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: |
|
| |