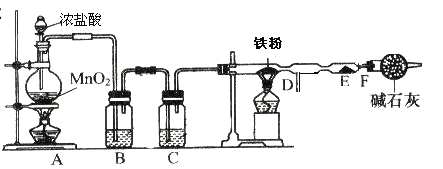
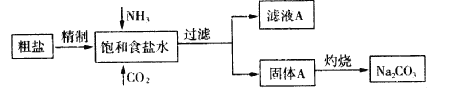
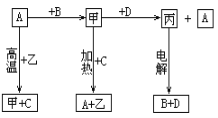
题目内容
【题目】(10分)常温下,现有A、B、C、D四种电解质分别完全溶于水,所得四种溶液中含H+、Ba2+、Al3+、Na+、HCO3-、Cl-、OH-、SO42-八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、气体、白色沉淀。
②经测定,A和D的溶液显碱性,B和C的溶液pH<7。B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀。
③C与D的溶液反应,无明显现象。经测定,该反应的产物总能量小于反应物总能量。
根据上述实验事实,请回答下列问题:
(1)C的名称是________,D的化学式_________。
(2)用离子方程式表示A的溶液显碱性的原因:_________________。
(3)A与B在溶液中反应的离子方程式为________________。
(4)等物质的量浓度、等体积的B和D的溶液混合,写出反应的离子方程式:_________________。
【答案】(10分)(各2分)(1)氯化氢;Ba(OH)2;
(2)HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓。
【解析】
试题分析:①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、白色沉淀、气体,结合离子之间的反应现象来判断,铝离子和碳酸氢根离子反应既产生白色沉淀又产生气体;钡离子和碳酸氢根离子、氢氧根离子之间的反应产生白色沉淀;氢离子和碳酸氢根离子之间反应产生水以及二氧化碳,A是NaHCO3。②经测定,A和D的溶液显碱性,则含有氢氧根离子或是HCO3-,B和C的溶液pH<7,则含有氢离子或是铝离子等;B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀,则一定是硫酸铝和氢氧化钡之间的反应,所以D是Ba(OH)2 ,B是Al2(SO4)3,③C与D的溶液反应,无明显现象,该反应的产物总能量小于反应物总能量,该反应是放热反应,所以C是HCl,综上知道A是NaHCO3, B是Al2(SO4)3,C是HCl,D是Ba(OH)2。(1)据上述分析可知C是盐酸,化学式是HCl,D是Ba(OH)2;(2)A是NaHCO3,碳酸氢根离子水解导致溶液显示碱性,盐水解程度是微弱的,主要以盐电离产生的离子存在,水解反应方程式为:HCO3-+H2O![]() H2CO3 +OH-;(3)碳酸氢钠溶液和硫酸铝之间发生盐的双水解反应,产生氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;(4)将等物质的量浓度、等体积的B和D的溶液混合,Al2(SO4)3过量,反应产生硫酸钡沉淀和氢氧化铝沉淀,反应的离子方程式是3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓。
H2CO3 +OH-;(3)碳酸氢钠溶液和硫酸铝之间发生盐的双水解反应,产生氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;(4)将等物质的量浓度、等体积的B和D的溶液混合,Al2(SO4)3过量,反应产生硫酸钡沉淀和氢氧化铝沉淀,反应的离子方程式是3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓。

【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a-c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 甲烷(甲醛) | 银氨溶液 | 萃取 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |