题目内容
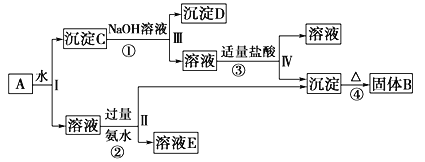
【题目】A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素,它们在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式为_______________________,由此判断实验室保存C的水溶液应加入____________(填试剂名称),3molD与足量水蒸气高温下充分反应转移的电子数为_______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为______________________。
(3)若C是一种能形成硫酸型酸雨的污染性气体,D是一种能支持燃烧和呼吸的气体,则反应③中氧化产物和还原产物的质量比为______________。
(4)若D是一种常见的温室气体,A、B、C的的焰色反应都呈黄色,现有120gB和C的混合物,充分加热后测得剩余固体质量为89g,则混合物中B的质量分数为_______
【答案】 2Fe3++Fe===3Fe2+ 铁 8NA 4NH3+5O2![]() 4NO+6H2O 2:1 30%
4NO+6H2O 2:1 30%
【解析】(1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2,则反应②的离子方程式为2Fe3++Fe=3Fe2+,实验室保存氯化亚铁的水溶液应加入铁粉,防止亚铁离子被氧化;3mol铁与足量水蒸气高温下充分反应生成四氧化三铁,转移的电子数为8NA,故答案为:2Fe3++Fe=3Fe2+;铁;8NA;
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,则D为氧气,C为二氧化氮。反应①的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若C是一种能形成硫酸型酸雨的污染性气体,应为SO2,D是一种能支持燃烧和呼吸的气体,D为O2,则A为H2S, B为S,反应③的化学方程式是2H2S+SO2=3S↓+2H2O,
氧化产物和还原产物都是硫,质量比2:1,故答案为:2:1;
(4)若D是一种常见的温室气体,则D为CO2,A、B、C的焰色反应都呈黄色,则A为NaOH,B为Na2CO3,C为NaHCO3。现有120g碳酸钠和碳酸氢钠的混合物,充分加热后测得剩余固体质量为89g,加热是时发生2NaHCO3![]() Na2CO3+H2O +CO2,则生成的二氧化碳和水的质量为120g-89g=31g,分解的碳酸氢钠为1mol,质量为84g,则碳酸钠为36g,碳酸钠的质量分数为
Na2CO3+H2O +CO2,则生成的二氧化碳和水的质量为120g-89g=31g,分解的碳酸氢钠为1mol,质量为84g,则碳酸钠为36g,碳酸钠的质量分数为![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。

 阅读快车系列答案
阅读快车系列答案