题目内容
【题目】乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成份。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展的重要标志)
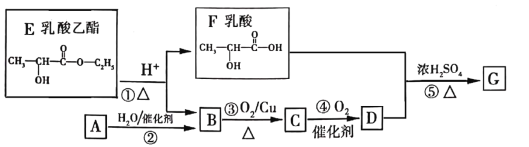
(1)A分子的空间构型是_______。
(2)D的化学式是_______________,F中含氧官能团的名称是______________。
(3)②的化学方程式是___________,⑤的反应类型是_________
(4)1mol乳酸与足量NaOH反应,消耗NaOH__________mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符号绿色化学要求的是__________(填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
【答案】平面长方形 C2H4O2 羟基、羧基 CH2 =CH2 +H2O ![]() CH 3CH2OH 酯化反应(取代反应) 1 c
CH 3CH2OH 酯化反应(取代反应) 1 c
【解析】
烃A是衡量一个国家石油化工发展的重要标志,则A为CH2=CH2;A与H2O发生加成反应生成B的结构简式为CH3CH2OH,催化氧化生成C的结构简式为CH3CHO,再催化氧化生成D的结构简式为CH3COOH;乳酸乙酯在酸性条件下水解生成乳酸和乙醇,乳酸与CH3COOH在浓硫酸、加热条件下发生酯化反应生成G的结构简式为![]() 。
。
(1)A为CH2=CH2,分子的空间构型是平面长方形。答案为:平面长方形;
(2)D为CH3COOH,化学式是C2H4O2,F为![]() ,含氧官能团的名称是羟基、羧基。答案为:C2H4O2;羟基、羧基;
,含氧官能团的名称是羟基、羧基。答案为:C2H4O2;羟基、羧基;
(3) 反应②为CH2=CH2与H2O加成生成CH3CH2OH,化学方程式是CH2=CH2 +H2O ![]() CH 3CH2OH,反应⑤是乳酸与CH3COOH在浓硫酸、加热条件下反应生成
CH 3CH2OH,反应⑤是乳酸与CH3COOH在浓硫酸、加热条件下反应生成![]() 和H2O,反应类型是酯化反应(取代反应)。答案为:CH2=CH2 +H2O
和H2O,反应类型是酯化反应(取代反应)。答案为:CH2=CH2 +H2O ![]() CH 3CH2OH;酯化反应(取代反应);
CH 3CH2OH;酯化反应(取代反应);
(4)乳酸的结构简式为![]() ,只有-COOH能与NaOH发生反应,所以1mol乳酸与足量NaOH反应,消耗NaOH 1 mol。答案为:1;
,只有-COOH能与NaOH发生反应,所以1mol乳酸与足量NaOH反应,消耗NaOH 1 mol。答案为:1;
(5) a.乙醇制取乙醛,发生反应为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,a不合题意;
2CH3CHO+2H2O,a不合题意;
b.甲烷制备CH3Cl,发生反应为CH4+Cl2![]() CH3Cl+HCl,b不合题意;
CH3Cl+HCl,b不合题意;
c.2CH3CHO+O2![]() 2CH3COOH,只生成一种产物,c符合题意;
2CH3COOH,只生成一种产物,c符合题意;
故选c。答案为:c。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案