题目内容
【题目】氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示

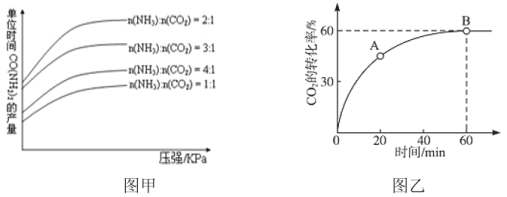
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
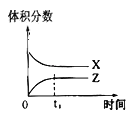
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
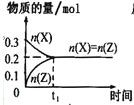
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
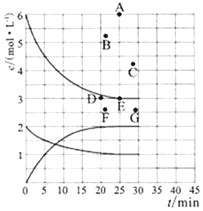
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
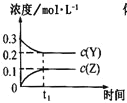
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)N2O4(g) H=-56.9kJmol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1c2(NO2),v逆(N2O4)=k2c(N2O4),其中k1、k2为速率常数,则373K时,![]() =_________;改变温度至T1时,k1=k
=_________;改变温度至T1时,k1=k
【答案】2NH3(g)+NO(g)+NO2(g)= 2N2(g)+3H2O(g) ΔH=-455.2 kJ/mol Mn,200°C(附近也算对) b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高; H2O+HNO2-2e-=NO3-+3H+ bc B 2×103mol/(L·min) 60 >
【解析】
(Ⅰ) (1)①若烟气中 c(NO2):c(NO)=1:1,发生如图甲所示的脱氮反应时,反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g),反应过程中转移 1.5mol 电子时放出的热量为 113.8kJ,电子转移6mol放热为455.2kJ,则标注物质聚集状态和对应反应的焓变得到热化学方程式;
②根据图乙分析,考虑适合的温度和高的脱氮率,据此选择合适的催化剂;
(2)用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,电解工作原理阳极失去电子,发生氧化反应,参与物质是硝酸来解答;
(Ⅱ) (1)①反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到不变时,说明可逆反应到达平衡状态;
②若起始充入4.00molN2和12.00molH2是充入2.00 molN2和6.00 molH2的2倍,相当加压、反应速率加快、达到平衡状态的时间缩短,但合成氨的正反应是气体体积减小的反应,增大压强、平衡正向移动,据此分析解答;
(2)①根据v=![]() 计算0~20min时的v(N2O4);
计算0~20min时的v(N2O4);
②反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以![]() =2×
=2×![]() =2K,根据反应三段式计算平衡时[φ(NO2)=0.4]各物质的平衡浓度,代入平衡常数K=
=2K,根据反应三段式计算平衡时[φ(NO2)=0.4]各物质的平衡浓度,代入平衡常数K=![]() 中计算K;该反应正向放热,升高温度,K减小,降低温度K增大。
中计算K;该反应正向放热,升高温度,K减小,降低温度K增大。
(Ⅰ) (1)①若烟气中 c(NO2):c(NO)=1:1,发生如图甲所示的脱氮反应时,反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g),反应过程中转移 1.5mol 电子时放出的热量为 113.8kJ,电子转移6mol放热为455.2kJ,则标注物质聚集状态和对应反应的焓变得到热化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=455.2kJ/mol;
②根据图乙分析,200°C时Mn的催化效率更高,500°C时,Cr的催化效率更高,相比之下,200°C的耗能更少,则工业选取的最佳催化剂及相应的温度分别为:Mn、200°C;ba段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高;
(2)用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,根据装置图,阳极发生氧化反应,亚硝酸被氧化为硝酸,电极反应式为H2O+HNO2-2e-=NO3-+3H+;
(Ⅱ) (1)①a.3v正(N2)=v逆(H2)的状态是平衡状态,所以v正(N2)=3v逆(H2)的状态不是平衡状态,故a错误;
b.该反应正向体积减小,恒温恒容条件下,反应正向进行、气体物质的量减小、压强降低,所以体系压强不变时达到平衡状态,故b正确;
c.体系中各物质均为气体,气体质量不变,该反应正向体积减小,恒温恒容条件下,反应正向进行、气体物质的量减小,气体平均相对分子质量增大,所以气体平均相对分子质量不变时达到平衡状态,故c正确;
d.体系中各物质均为气体,气体质量不变,恒温恒容条件下,气体密度始终不变,所以气体密度不变不能判定反应达到平衡状态,故d错误;
故答案为:bc;
②由图可知,将2.00molN2和6.00molH2充入1L密闭容器中,达到平衡时,c(H2)=3mol/L,即E点;若起始充入4.00molN2和12.00molH2,是恒容容器中充入的2.00 molN2和6.00 molH2的2倍,相当加压、反应速率加快、先达到平衡状态,但加压时平衡正向移动,使c(H2)小于6mol/L,故为B点;
(2)①设c(N2O4)=x,2NO2(g)N2O4(g),则c(NO2)=2x,起始时c(NO2)=0.2mol/L,20min时[φ(NO2)]=0.75,即![]() =0.75,x=0.04mol/L,020min时,v(N2O4)=
=0.75,x=0.04mol/L,020min时,v(N2O4)=![]() =2×103mol/(Lmin);
=2×103mol/(Lmin);
②反应三段式为:

平衡时φ(NO2)=0.4,![]() =0.4,y=0.075mol/L,平衡常数K=
=0.4,y=0.075mol/L,平衡常数K=![]() =
=![]() =30,反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以
=30,反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以![]() =2×
=2×![]() =2K=60;2NO2(g)N2O4(g)△H=56.9kJmol1,升高温度平衡常数减小,T1时k1=k2,则
=2K=60;2NO2(g)N2O4(g)△H=56.9kJmol1,升高温度平衡常数减小,T1时k1=k2,则![]() =1=2K′,平衡常数K′=0.5<30,所以T1>373K。
=1=2K′,平衡常数K′=0.5<30,所以T1>373K。

 口算题天天练系列答案
口算题天天练系列答案