题目内容
【题目】现要测定某氯化铁与氯化亚铁混合物中铁元素的质量分数。实验按以下步骤进行:
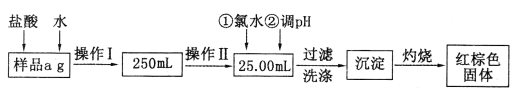
I.根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______(填仪器名称)。
(2)加入氯水发生反应的离子方程式为______________________________。
(3)将沉淀物灼烧后,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温,称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是___________________;若坩埚质量是w1g,坩埚与灼烧后固体总质量是w2g,则样品中铁元素的质量分数是_______________。
II.有同学提出,还可以采用以下方法来测定:
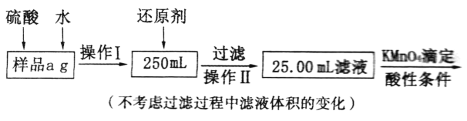
(4)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________________。
(5)选择的还原剂是否能用铁_____(填“是”或“否”),原因是______________________。
(6))若滴定消耗c mol· L-1KMnO4溶液b mL,则样品中铁元素的质量分数是__________。
【答案】250mL容量瓶 胶头滴管 2Fe2++Cl2=2Fe3++2Cl- 再次加热冷却并称量,直至两次质量差小于0.1g ![]() ×100% 过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰 否 如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定 2.8bc/a
×100% 过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰 否 如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定 2.8bc/a
【解析】
本题按照两种不同的实验设计进行了某氯化铁与氯化亚铁混合物中铁元素的质量分数,方案I为沉淀法,方案II滴定法,两种方案中均是先准确配制一定体积的溶液,然后取样进行测定,计算的依据为铁元素的质量守恒,据此分析解答。
Ⅰ.(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有250mL容量瓶、胶头滴管;故答案为:250mL容量瓶、胶头滴管;
(2)加入氯水将溶液中的Fe2+氧化转变成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,因b1-b2=0.3g>0.1g,所以接下来需再次加热冷却并称量,直至两次质量差小于0.1g;由铁元素质量守恒可得红棕色固体中铁元素就是样品中的铁,Fe2O3中铁元素的质量为(W2-W1)g×![]() ;则样品中铁元素的质量为:(W2-W1)g×
;则样品中铁元素的质量为:(W2-W1)g×![]() ×
×![]() =
=![]() g=7(W2-W1)g,所以样品中铁元素的质量分数为:
g=7(W2-W1)g,所以样品中铁元素的质量分数为:![]() ×100%,故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;
×100%,故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;![]() ×100%;
×100%;
II.(4)溶解样品改用了硫酸,而不再用盐酸,是因为过量的盐酸会被酸性KMnO4溶液氧化,对KMnO4的滴定有干扰,故答案为:过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰;
(5)选择的还原剂不能用铁,因为如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,从而干扰原混合物中铁元素的测定;故答案为:否;如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定;
(6)Fe与KMnO4反应的离子方程式是:5Fe2++ MnO4-+8H+= 5Fe3++Mn2++4H2O。n(MnO4-)=bc×10-3mol;则n(Fe2+)= 5bc×10-3mol,则样品中铁元素的质量分数是(10×5bc×10-3mol×56g/mol)÷a=2.8bc/a,故答案为:2.8bc/a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案