题目内容
【题目】为了除去铝表面的铜镀层,可选用的试剂是( )
A.烧碱溶液
B.盐酸
C.稀硝酸
D.浓硝酸
【答案】D
【解析】解:A.Al与NaOH溶液反应,不能除杂,故A错误;
B.Al与盐酸反应,而Cu不能,不能除杂,故B错误;
C.Cu、Al与稀硝酸都可以发生反应,不能除杂,故C错误;
D.常温下Al遇浓硝酸发生钝化,而Cu常温下与浓硝酸反应,则可利用浓硝酸除杂,故D正确;
故选D.
【考点精析】通过灵活运用铝的化学性质,掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应即可以解答此题.

【题目】下图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:
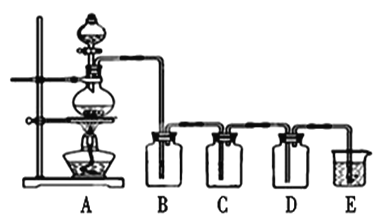
(1)实验步骤: 连接仪器、_________________、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是___________________________。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是________________,_________________。证明气体中有CO2的现象是____________________________。
(4)将A产生的气体通入下图装置(忽略氧气对反应的影响)进行如下探究实验。
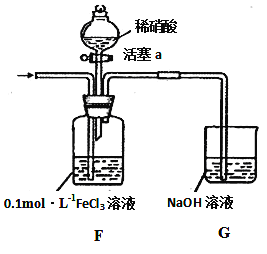
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向F装置中通入一段时间的气体. | F中溶液色溶液最终变为浅绿色 |
II | 取出少量F装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液 | 加入KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
III | 打开活塞a,将过量稀HNO3加入装置F中,关闭活塞a | F中浅绿色溶液最终变为黄色. |
IV | 取出少量A装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
实验II中发生反应的离子方程式是_____________________;实验III中,浅绿色溶液变为黄色的原因是___________________________________________ (用语言叙述);综合上述实验得岀的结论是:在酸性条件下,NO3﹣、Fe3+氧化性强弱顺序为_____________________
