题目内容
已知:CH4(气)+2O2(气)=2H2O(液)+CO2(气)+890.3千焦,1克氢气和1克甲烷分别燃烧后,放出的热量之比约是( )
| A、1:3.4 | B、1:1.7 | C、2.3:1 | D、4.6:1 |
分析:根据反应的化学方程式找出可燃物的质量与放出的热量之间的关系然后求得1gH2与1gCH4分别燃烧后放出的热量.
解答:解:氢气的燃烧热为285.8kJ/mol,1molH2燃烧生成稳定氧化物放出热量为285.8kJ/mol,
所以1克氢气燃烧后放出的热量为
=142.9kJ,
由CH4(气)+2O2(气)=2H2O(液)+CO2(气)+890.3千焦,
则1gCH4燃烧后放出的热量为
=55.6KJ,
所以1gH2与1gCH4分别燃烧后放出的热量之比为:129.9KJ:55.6KJ=2.3:1,
故选C.
所以1克氢气燃烧后放出的热量为
| 285.8kJ |
| 2 |
由CH4(气)+2O2(气)=2H2O(液)+CO2(气)+890.3千焦,
则1gCH4燃烧后放出的热量为
| 890.3kJ |
| 16 |
所以1gH2与1gCH4分别燃烧后放出的热量之比为:129.9KJ:55.6KJ=2.3:1,
故选C.
点评:本题需根据化学方程式知道物质的质量与放出的热量之间的关系,需要记住氢气的燃烧热才能够进行正确的计算.

练习册系列答案
相关题目
 合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用.
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用.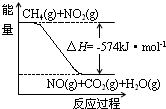 氮及其化合物与人们的生活息息相关.
氮及其化合物与人们的生活息息相关.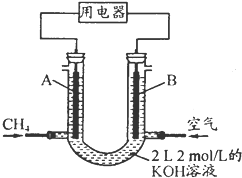 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.