题目内容
 氮及其化合物与人们的生活息息相关.
氮及其化合物与人们的生活息息相关.(1)氮元素在周期表中的位置是
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据①和②,标准状况下,4.48L CH4恰好将NO2转化为N2时,△H=
关于①和②,下列说法正确的是
a.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H<-574kJ?mol-1
b.等物质的量的甲烷分别发生反应①、②,转移电子数相同
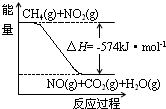
c.如图可表示①的反应过程和能量关系
(4)同温同压下,3.5L NH3恰好将3.0L NO和NO2的混合气完全转化为N2,则原混合气中 NO和NO2的体积比是
分析:(1)氮元素原子核外有2个电子层,最外层电子数为5,据此解答;
(2)铜与稀硝酸反应生成硝酸铜、NO与水;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2;
(3)根据盖斯定律书写CH4将NO2转化为N2的热化学方程式,再计算4.48L CH4的物质的量,结合热化学方程式计算;
a.气态水的能量比液态水的能量,生成液态水放出的热量更多;
b.两个反应中只有甲烷为还原剂,都氧化生成二氧化碳,甲烷的物质的量相等,转移电子数目相等;
c.反应过程与能量关系图象应指明具体物质的物质的量;
(4)令NO和NO2的体积分别为xL、yL,根据二者体积与电子转移守恒列方程计算.
(2)铜与稀硝酸反应生成硝酸铜、NO与水;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2;
(3)根据盖斯定律书写CH4将NO2转化为N2的热化学方程式,再计算4.48L CH4的物质的量,结合热化学方程式计算;
a.气态水的能量比液态水的能量,生成液态水放出的热量更多;
b.两个反应中只有甲烷为还原剂,都氧化生成二氧化碳,甲烷的物质的量相等,转移电子数目相等;
c.反应过程与能量关系图象应指明具体物质的物质的量;
(4)令NO和NO2的体积分别为xL、yL,根据二者体积与电子转移守恒列方程计算.
解答:解:(1)氮元素原子核外有2个电子层,最外层电子数为5,氮元素处于第二周期第ⅤA族;
故答案为:第二周期第ⅤA族;
(2)铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;NaNO2;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律,①+②得2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)△H=-1734kJ?mol-1
标准状况下,4.48L CH4的物质的量为0.2mol,故标准状况下,4.48L CH4恰好将NO2转化为N2时,△H=(-1734kJ?mol-1)×
=-173.4 kJ?mol-1;
a.气态水的能量比液态水的能量,生成液态水放出的热量更多,故a正确;
b.两个反应中只有甲烷为还原剂,都氧化生成二氧化碳,甲烷的物质的量相等,转移电子数目相等,故b正确;
c.反应过程与能量关系图象应指明具体物质的物质的量,故c错误;
故答案为:-173.4 kJ?mol-1;ab;
(4)令NO和NO2的体积分别为xL、yL,
由二者体积之和可得:x+y=3,
体积之比等于物质的量之比,由电荷守恒可知:2x+4y=3.5×3,
联立方程,解得x=0.75,y=2.25,
故原混合气中 NO和NO2的体积比是0.75:2.25=1:3,
故答案为:1:3.
故答案为:第二周期第ⅤA族;
(2)铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;NaNO2;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律,①+②得2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)△H=-1734kJ?mol-1
标准状况下,4.48L CH4的物质的量为0.2mol,故标准状况下,4.48L CH4恰好将NO2转化为N2时,△H=(-1734kJ?mol-1)×
| 0.2mol |
| 2mol |
a.气态水的能量比液态水的能量,生成液态水放出的热量更多,故a正确;
b.两个反应中只有甲烷为还原剂,都氧化生成二氧化碳,甲烷的物质的量相等,转移电子数目相等,故b正确;
c.反应过程与能量关系图象应指明具体物质的物质的量,故c错误;
故答案为:-173.4 kJ?mol-1;ab;
(4)令NO和NO2的体积分别为xL、yL,
由二者体积之和可得:x+y=3,
体积之比等于物质的量之比,由电荷守恒可知:2x+4y=3.5×3,
联立方程,解得x=0.75,y=2.25,
故原混合气中 NO和NO2的体积比是0.75:2.25=1:3,
故答案为:1:3.
点评:本题考查结构位置关系、常用化学用语、反应热的有关计算、氧化还原反应等,难度中等,是对学生运用知识解决问题的综合考查.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
 。
。