题目内容
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)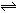 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.B的平均反应速率为0.04 mol·L-1·min-1
D.A的转化率20%
【答案】
A
【解析】
试题分析:根据反应方程式可知:0.4 mol C,则消耗0.2mol的A,消耗0.2X的B,剩余的A为(1-0.2)mol,B为(3-0.2X)mol,解得X=4,平衡时,物质的量比A∶B∶C=0.8∶1.4∶0.4=4:7:2. B的反应速率为(0.2mol×4)÷10L÷2min=0.04mol/(L·min).A的转化率为0.2mol÷1mol×100%=20%.因此计算结果不正确的是A。
考点:考查化学平衡的有关计算的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
反应4NH3(g)+5O2(g)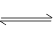 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
| A.v(NH3)=0.010 mol·(L·s)-1 | B.v(O2)=0.001 mol·(L·s)-1 |
| C.v(NO)=0.0010 mol·(L·s)-1 | D.v(H2O)=0.045 mol·(L·s)-1 |
 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( )
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( ) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为