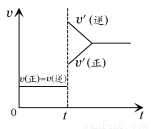
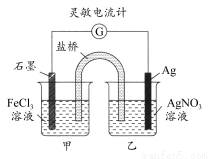
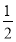题目内容
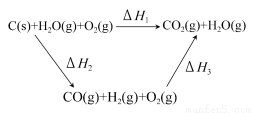
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
A
【解析】由题意可知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol ①
H2(g)+ O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l);ΔH=-870.3 kJ/mol ③
①×2+②×2-③即得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);ΔH=-488.3 kJ/mol。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目