题目内容
1 mol某烃A,充分燃烧可以得到8 mol CO2和4 mol H2O。烃A可通过如图1-4-21所示的各个反应得到各种化合物和聚合物。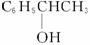
图1-4-21
(1)以下11个反应中,属于消去反应的有__________ (填数字)个。它们分别是:由C→A,__________ (填写X→Y)。
(2)化合物的结构简式:A是__________,D是__________,E是__________,G是__________。
解析:反应条件及物质间的转换关系图是本题的突破口,由C→A,即可推知E→F也是消去反应。关键是隐含的E→A,其反应条件是较新的信息,不易察觉。转换关系起了重要的补充信息作用。确定了E→A,自然就得知G→F也是消去反应。
答案:(1)4 E→A、E→F、G→F
(2)C6H5CH=CH2 ![]()
![]() C6H5CBr2CHBr2
C6H5CBr2CHBr2

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。
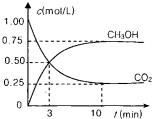
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=_______;能使平衡体系中n(CH3OH)增大的措施有______。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g) CO2(g)+2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g) H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是_________[填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定__________。
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入 2
mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)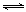 CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
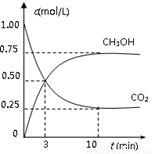
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1=―890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
 (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.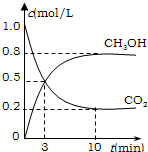 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究. .
. O
O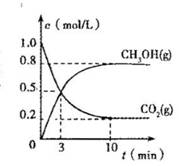
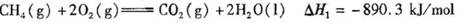


 越小,表示该物质在水中越易沉淀)
越小,表示该物质在水中越易沉淀)