题目内容
下列叙述中正确的是( )
| A、一切四面体空间构型的分子内键角均为109°28′ |
| B、Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,中心离子为Cu2+,配位体是NH3 |
| C、任何晶体,若含阳离子也一定含阴离子 |
| D、水分子稳定是因为水分子间存在氢键作用 |
考点:判断简单分子或离子的构型,配合物的成键情况,含有氢键的物质,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.不是所有的四面体空间构型的分子内键角均为109°28′;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键,Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,该离子中中心离子是铜离子,配体是氨气分子;
C.金属晶体含有组成微粒为阳离子和电子;
D.氢键与分子的稳定性无关,水分子稳定是因为水中的共价键强;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键,Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,该离子中中心离子是铜离子,配体是氨气分子;
C.金属晶体含有组成微粒为阳离子和电子;
D.氢键与分子的稳定性无关,水分子稳定是因为水中的共价键强;
解答:
解:A.空间构型为四面体型的分子,有的键角为109°28′,如甲烷分子,有的不是,如白磷的空间结构图为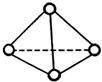 ,为正四面体结构,每个P原子与3个P原子形成共价键,每个键角为60°,故A错误;
,为正四面体结构,每个P原子与3个P原子形成共价键,每个键角为60°,故A错误;
B.Cu(OH)2能溶于过量氨水Cu2++4NH3?H2O=Cu(NH3)42++4H2O,形成络合物[Cu(NH3)4]2+,在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,N原子提供孤电子对,中心离子Cu2+,配体是NH3,故B正确;
C.晶体只要有阳离子不一定有阴离子,如金属晶体含有组成微粒为阳离子和电子,故C错误;
D.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故D错误;
故选B.
 ,为正四面体结构,每个P原子与3个P原子形成共价键,每个键角为60°,故A错误;
,为正四面体结构,每个P原子与3个P原子形成共价键,每个键角为60°,故A错误;B.Cu(OH)2能溶于过量氨水Cu2++4NH3?H2O=Cu(NH3)42++4H2O,形成络合物[Cu(NH3)4]2+,在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,N原子提供孤电子对,中心离子Cu2+,配体是NH3,故B正确;
C.晶体只要有阳离子不一定有阴离子,如金属晶体含有组成微粒为阳离子和电子,故C错误;
D.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故D错误;
故选B.
点评:本题考查了键角、配合物的构成、晶体、氢键等知识,注意氢键只影响物质的物理性质,与物质的稳定性无关,注意配合物形成配位键的条件,题目难度中等.

练习册系列答案
相关题目
为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A、HCl的溶解性强于H2S |
| B、氯的最高价为+7价 |
| C、H2S中的S2-能被Cl2氧化 |
| D、HClO的氧化性强于H2SO4 |
氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A、该分子不能发生加成反应 |
| B、分子中N≡C键的键长大于C-C键的键长 |
| C、分子中含有3个σ键和4个π键 |
| D、不和氢氧化钠溶液发生反应 |
化学与能源开发,环境保护、生产生活等密切相关.下列有关说法正确的是( )
| A、二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、明矾可用于净水是因为它能够消毒杀菌 |
| D、静电除尘、血液透析均与胶体性质相关 |
原子序数从11~18的元素,随着核电荷数的递增而逐渐增大的是( )
| A、电子层数 | B、核外电子数 |
| C、原子半径 | D、最外层电子数 |
(双选)下列变化中属于原电池反应的是( )
| A、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
| B、在空气中金属铝表面迅速被氧化形成保护膜 |
| C、红热的铁丝与水接触表面形成蓝色保护层 |
| D、在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
由黄铁矿炼铜的过程中发生了反应:Cu2S+2Cu2O
6Cu+SO2↑,下列叙述正确的是( )
| ||
| A、该反应从氧化还原反应的电子转移看,与SO2+2H2S═3S+2H2O是同一反应类型 | ||||
| B、该反应中,氧元素氧化了硫元素 | ||||
C、该反应从氧化还原反应的电子转移角度看,与6NO2+8NH3
| ||||
| D、该反应中,Cu2S既是还原剂又是氧化剂 |
根据下列物质的化学性质,判断其应用错误的是( )
| A、酒精能使蛋白质变性,可用于杀菌消毒 |
| B、CaO能用于燃煤的脱硫 |
| C、明矾水解时产生具有吸附性的胶体粒子,可以除去水中的杂质离子 |
| D、氯气泄露时,人群应向高处疏散 |