题目内容
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:_____S2O82-+____Mn2++_____=____MnO4-+____SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
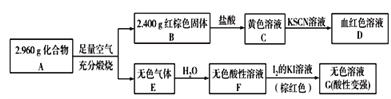
①已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的化学方程式:_______________________。
②已知25 ℃时,Ksp[Fe(OH)3]=8×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
(4)①FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2![]() Fe+2Li2S,正极反应式是____。
Fe+2Li2S,正极反应式是____。
②FeSO4可转化为FeCO3,FeCO3在空气中加热会发生反应,可制得铁系氧化物材料。已知25 ℃、101 kPa时:4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)
2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
【答案】 +6 5 2 8H2O 2 10 16H+ S2O32-+4Cl2+ 5H2O=2SO42- +8C1-+ 10 H+ Fe3S4+6HCl=3H2S↑+3FeCl2 +S K=![]() =
=![]() =
=![]() =8×103 2.3 FeS2+4e-
=8×103 2.3 FeS2+4e-![]() Fe+2S2- 4FeCO3(s)+O2(g)
Fe+2S2- 4FeCO3(s)+O2(g)![]() 2Fe2O3(s) +4CO2(g) ΔH=-256 kJ·mol-1
2Fe2O3(s) +4CO2(g) ΔH=-256 kJ·mol-1
【解析】(1)①过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸,在—SO3H基中S元素的化合价为+6价,因此(NH4)2S2O8中硫元素的化合价为+6价,故答案为:+6;
②在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应,根据化合价升降守恒,配平得:5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+,故答案为:5;2;8H2O;2;10;16H+;
(2)大苏打的成分是Na2S2O3·5H2O,其中S元素的化合价为+2价,具有比较强的还原性,若1 mol Na2S2O3完全反应,失去8mol电子,说明生成硫酸根离子,因此Na2S2O3水溶液吸收氯气的离子方程式为S2O32-+4Cl2+ 5H2O=2SO42- +8C1-+ 10 H+,故答案为:S2O32-+4Cl2+ 5H2O=2SO42- +8C1-+ 10 H+;
(3) C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)= ![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)= ![]() =0.04mol,可知n(Fe):n(S)=3:4,A为Fe3S4。
=0.04mol,可知n(Fe):n(S)=3:4,A为Fe3S4。
①化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,反应的化学方程式为Fe3S4+6HCl=3H2S↑+3FeCl2 +S,故答案为:Fe3S4+6HCl=3H2S↑+3FeCl2 +S;
②Fe(OH)3+3H+![]() Fe3++3H2O,25℃时Ksp[Fe(OH)3]=8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=
Fe3++3H2O,25℃时Ksp[Fe(OH)3]=8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=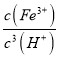 =
=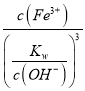 =
=![]() =
=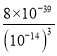 =8×103;向0.001mob/LFeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液中c(OH-)=
=8×103;向0.001mob/LFeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液中c(OH-)=![]() =2×10-12mol/L,故c(H+)=
=2×10-12mol/L,故c(H+)=![]() =5×10-3mol/L,故pH=-lgc(H+)=-lg5×10-3=2.3,故答案为:K=
=5×10-3mol/L,故pH=-lgc(H+)=-lg5×10-3=2.3,故答案为:K=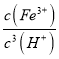 =
=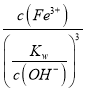 =
=![]() =
=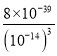 =8×103;2.3。
=8×103;2.3。
(4)①电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,故答案为:FeS2+4e-=Fe+2S2-;
②发生反应:4FeCO3+O2![]() 2Fe2O3+4CO2,已知:i.4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol,ii.C(s)+O2(g)═CO2(g)△H=-392kJ/mol,iii.2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol,根据盖斯定律,i-iii×2+ii×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-392kJ/mol)=-256kJ/mol,故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-256kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol。
2Fe2O3+4CO2,已知:i.4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol,ii.C(s)+O2(g)═CO2(g)△H=-392kJ/mol,iii.2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol,根据盖斯定律,i-iii×2+ii×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-392kJ/mol)=-256kJ/mol,故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-256kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol。

 应用题作业本系列答案
应用题作业本系列答案