题目内容
镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:
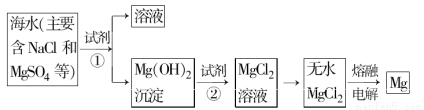
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂②可以选用 ,其反应的离子方程式为 。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式 。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为 mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为 L。
(1)Ca(OH)2 (2)过滤
(3)盐酸 Mg(OH)2+2H+=Mg2++2H2O
(4)MgCl2(熔融)  Mg+Cl2↑
Mg+Cl2↑
(5)5.50 9.09×108
【解析】Ca(OH)2在海边可以通过以下反应获得:CaCO3(贝壳) 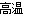 CaO+CO2↑ CaO+H2O=Ca(OH)2
CaO+CO2↑ CaO+H2O=Ca(OH)2

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目