题目内容
下列各组物质的性质顺序,不正确的是
| A.原子半径:Na<Mg<Al | B.热稳定性:HCl>HBr>HI |
| C.酸性强弱:H2SiO4<H2CO3<H2SO4 | D.熔点:SiO2>NaCl>CO2 |
A
A 错误,原子半径:Na>Mg>Al
B 正确,对于结构相似的物质,半径越小,越稳定。
C 正确,碳和硅是同一主族,碳的非金属性强于硅的,所以碳酸的酸性强于硅酸的酸性,硫酸是强酸,是三者当中酸性最强的酸。
D 正确,原子晶体的熔点大于离子晶体的熔点大于分子晶体的熔点。
B 正确,对于结构相似的物质,半径越小,越稳定。
C 正确,碳和硅是同一主族,碳的非金属性强于硅的,所以碳酸的酸性强于硅酸的酸性,硫酸是强酸,是三者当中酸性最强的酸。
D 正确,原子晶体的熔点大于离子晶体的熔点大于分子晶体的熔点。

练习册系列答案
相关题目
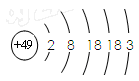
 中, 共有x个核外电子,R 原子的质量数为 A,则R原子核内含有的中子数目是
中, 共有x个核外电子,R 原子的质量数为 A,则R原子核内含有的中子数目是 D.稳定性:H2A > HC
D.稳定性:H2A > HC