题目内容
11.下列离子方程式书写正确的是:( )| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | NH4HCO3溶液与过量NaOH溶液反应:OH-+NH4+═H2O+NH3↑ |
分析 A.醋酸 为弱酸应保留化学式;
B.二者反应生成碳酸钙和水;
C.二者反应生成硫酸钡、硫酸钠和水;
D.漏掉碳酸氢根离子与氢氧根离子的反应.
解答 解:A.用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.Ca(HCO3)2与过量Ca(OH)2溶液反应,离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.过量的NaHSO4与Ba(OH)2溶液反应,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C正确;
D.NH4HCO3溶液与过量NaOH溶液反应,离子方程式:HCO3-+2OH-+NH4+═2H2O+NH3↑+CO32-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,选项BC为易错选项,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
20.${\;}_{53}^{131}$I是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏.下列有关有叙述中错误的是( )
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
6.下列说法正确的是( )
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,而后者是电解质 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
16.下表中每组均有4个选项,请选出1个选项,它跟另外3个选项属于不同的分类,
| 组别 | 备选项 | 挑选项序号 |
| 1 | A.NO B.CO2 C.SO2 D.P2O5 | |
| 2 | A.S2- B.I-C.Fe D.K+ | |
| 3 | A.HCl B.CO2 C.NH3 D.Cl2 |
3.相同温度和压强下,1mol CO 和 1mol CO2相比较,下列说法不正确的是( )
| A. | 体积相同,但不一定是22.4 L | B. | 分子数相同,但原子数不同 | ||
| C. | 摩尔质量不同,氧原子个数相同 | D. | 质子数不同,电子数也不同 |
1.取100mL1.05mol•L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中硫酸的物质的量浓度是( )
| A. | 0.21mol•L-1 | B. | 0.42mol•L-1 | C. | 0.56mol•L-1 | D. | 0.26mol•L-1 |
 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: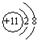 .
.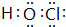 .
.


 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.