题目内容
【题目】氮及其化合物与人们的生活息息相关。回答下列问题:
I.(1)已知:①CO 的燃烧热H1=-283 kJ·mol1
②N2(g)+O2(g)=2NO(g) H2=+183 kJ·mol1
①写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式_________________。
②一定条件下当 NO 与 CO 的反应达到平衡后,既能提高反应速率又能提高 NO 转化率的措施有 ______(填 字母序号)。
a.压缩反应器体积 b.使用更高效催化剂 c.升高反反应温度 d.增大CO的浓度
(2)一定条件下在容积为8L的密闭容器中充入10molCO 和 8molNO,若反应进行到 20 min 时达到平衡状态,测得平衡体系压强为 8 MPaNO 的的体积分数为25%,则NO的转化率=________;用 CO2 浓度变化表示的平均反应速率 v(CO2)=_______;该温度下平衡常数 Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
II.用电解法可除去硝酸工业产生的尾气NO,并得到 NH4NO3,工作原理如下图。

(1)N 极应连接电源的______(填“正极”或“负极”);M 极的电极反应式为________。
(2)理论上通入NO与NH3 的最佳物质的量之比为________。
【答案】2NO(g)+ 2CO (g) = 2CO2 (g)+N2 (g) △H=-749 kJ·mol1 a d 50% 0.025mol·L1·min1 0.11 或 0.11MPa1 正极 NO+5e+6H+ =NH4++H2O 4:1
【解析】
I.(1)①根据盖斯定律求出反应热,写出热化学反应方程式;
②该反应为气体体积减小的放热反应,增大压强和增大CO的浓度都能加快反应速率,且使NO的转化率增大;
(2)根据NO 的的体积分数,列出三行式,求出转化量和平衡量,再依次求出二氧化碳的浓度,用CO2的浓度变化表示的平均反应速率,结合平衡时总压求出平衡分压代替平衡浓度的平衡常数;
II.(1)N极是NO失去电子转化为硝酸根,氮元素化合价升高,失去电子,为阳极,应连接电源的正极,M极上NO转化为铵根,发生还原反应。
(2)根据总反应方程式为8NO+7H2O![]() 3NH4NO3+2HNO3,生成的硝酸和反应的NO的物质的量之比等于2∶8=1∶4,通入的NH3的物质的量至少应与生成的硝酸的物质的量相等,据此分析。
3NH4NO3+2HNO3,生成的硝酸和反应的NO的物质的量之比等于2∶8=1∶4,通入的NH3的物质的量至少应与生成的硝酸的物质的量相等,据此分析。
I.(1)①已知:CO的燃烧热△H1=-283 kJ·mol-1,则
①2CO(g)+O2(g)![]() 2CO2(g)△H=-566 kJ·moL-1
2CO2(g)△H=-566 kJ·moL-1
②N2(g)+O2(g)=2NO(g)△H2=+183kJ·mol-1。
根据盖斯定律可知①-②即得到NO和CO反应生成无污染性气体的热化学反应方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-749 kJ·moL-1。
N2(g)+2CO2(g)△H=-749 kJ·moL-1。
②a.压缩反应器体积,压强增大,反应速率加快,平衡向正反应方向进行,转化率增大,a正确;
b.使用更高效催化剂不影响平衡,b错误;
c.升高温度平衡向逆反应方向进行,转化率降低,c错误;
d.增大CO的浓度提高反应速率的同时提高NO的转化率,d正确,
因此,本题正确答案为:2NO(g)+ 2CO (g) = 2CO2 (g)+N2 (g) △H=-749 kJ·mol1 ;a d;
(2)若反应进行到20 min达到平衡状态,容器的体积为8L,平衡时NO体积分数是0.25,则根据方程式可知
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 10 8 0 0
转化量(mol) 2x 2x x 2x
平衡量(mol) 10-2x 8-2x x 2x
![]() =0.25,解得x=2,所以此时NO的转化率为:
=0.25,解得x=2,所以此时NO的转化率为:![]() ×100%=50%。
×100%=50%。
二氧化碳浓度![]() =0.5mol/L,
=0.5mol/L,
因此用CO2的浓度变化表示的平均反应速率v(CO2)=![]() =0.025mol·L1·min1;
=0.025mol·L1·min1;
该温度下平衡常数Kp=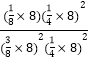 =0.11;
=0.11;
因此,本题正确答案为:50% ;0.025mol·L1·min1;0.11 或 0.11MPa1;
II.(1)N极是NO失去电子转化为硝酸根,氮元素化合价升高,失去电子,为阳极,应连接电源的正极,M极上NO转化为铵根,电极反应式为NO+5e+6H+ =NH4++H2O。
因此,本题正确答案为:正极;NO+5e+6H+ =NH4++H2O;
(2)总反应方程式为8NO+7H2O![]() 3NH4NO3+2HNO3,生成的硝酸和反应的NO的物质的量之比等于2∶8=1∶4,通入的NH3的物质的量至少应与生成的硝酸的物质的量相等,因此通入NO与NH3 的最佳物质的量之比为4:1。
3NH4NO3+2HNO3,生成的硝酸和反应的NO的物质的量之比等于2∶8=1∶4,通入的NH3的物质的量至少应与生成的硝酸的物质的量相等,因此通入NO与NH3 的最佳物质的量之比为4:1。
因此,本题正确答案为:4:1。

【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14
【题目】一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应 2CH3OH(g)![]() CH3OCH3( g)+H2O(g)
CH3OCH3( g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mmol) | 平衡物质的量 (mol) | |
编号 | ||||
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.10 | 0.040 | 0.040 |
Ⅱ | 387 | 0.20 | ||
Ⅲ | 207 | 0.20 | 0.090 | .090 |
则下列说法正确的是
A. 该反应的H﹥0
B. 达到平衡时,CH3OH 体积分数容器Ⅱ中的比容器 I 中的大
C. 反应达到平衡所需时间容器Ⅱ比容器Ⅲ长
D. 207℃ 若向容器Ⅳ( 1.0L 恒容密闭)充入 CH3OH 0.1mol、CH3OCH3 0.15mol 和 H2O0.20mol, 则反应将向正反应方向进行

