题目内容
在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)人类利用能源分为三个阶段,即________、________、________。
(2)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是________。(填序号,下同)
A.石油 B.煤 C.天然气 D.生物质能
(3)下列对能源的看法合理的是 ( )。
A.化石能源属于不可再生能源,只会越用越少
B.生物能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
(1)柴草时期 化石能源时期 多能源结构时期
(2)D (3)ABCD
解析

碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)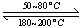 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
已知:C(s)+
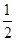 O2(g)=CO(g)
O2(g)=CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1C(s)+ O2(g)=CO2(g)
 H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1S(s)+O2(g)=SO2(g)
 H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1则SO2(g)+2CO(g)=S(s)+2CO2(g)
 H= 。
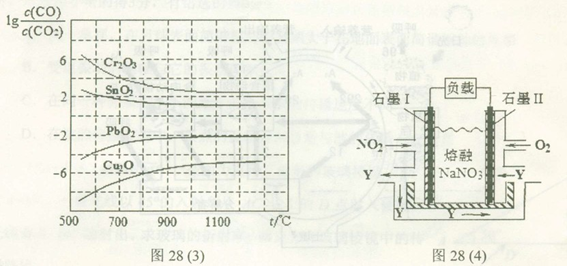
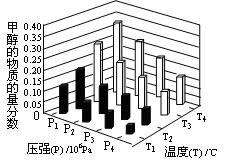
H= 。(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
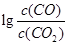 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
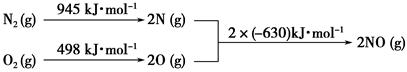
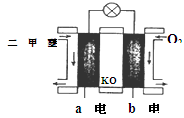
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
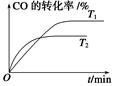
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)
 2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。 氮元素的化合物种类繁多,性质也各不相同。
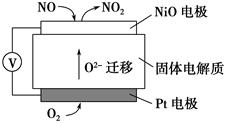
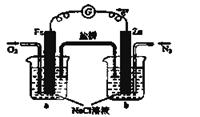
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为_________________________________。
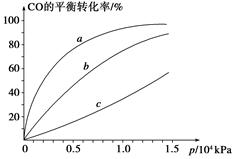
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g) N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为______________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:
__________________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=__________________。

 CH3OCH3+H2O
CH3OCH3+H2O CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol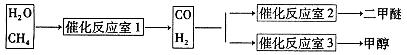
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
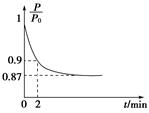
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。