题目内容
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为_________________________________。
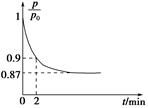
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g) N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为______________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:
__________________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=__________________。
(1)NO2(g)+SO2(g)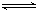 SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分)
SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分)
(2)40%(2分)
(3) 1.12L(2分);N2H4+H2O N2H5++OH- (2分)
N2H5++OH- (2分)
(4) Kb(NH3·H2O)=1×10-5mol/L(2分)
解析试题分析:(1)根据图1可得:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ?mol?1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律可得NO2(g)+SO2(g)
2SO3(g) ΔH=-196.6kJ?mol?1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律可得NO2(g)+SO2(g)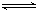 SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ?mol?1
SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ?mol?1
(2)气体的压强之比等于物质的量之比,根据三段式进行计算:设氨气的转化率为x
2NH3(g) N2(g)+3H2(g)
N2(g)+3H2(g)
起始物质的量(mol) 1 0 0
转化物质的量(mol) x x/2 3/2x
平衡物质的量(mol) 1-x x/2 3/2x
1:(1+x)=5:7,解得x=40%
(3)N2H4转化为N2,N元素由 -2价升高至0价,所以电子转移为:N2H4 ~ N2 ~ 4e?,n(N2)=1/4n(e?)=0.05mol,故在标准状况下的体积为1.12L;联氨溶于水可以发生与氨水类似的电离,N2H4与H+形成配位键,所以电离方程式为:N2H4+H2O N2H5++OH-
N2H5++OH-
(4)c(OH?)=Kw/c(H+)=10-9mol?L?1,c(NH3?H2O)=c(H+)=10-5mol?L?1,所以Kb(NH3·H2O)=c(NH4+)?c(OH?)/c(NH3?H2O)=0.1mol/L×10-9mol?L?1/10-5mol?L?1=1×10-5mol/L
考点:本题考查热化学方程式的书写、化学平衡和平衡常数的计算、电离方程式的书写。

(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。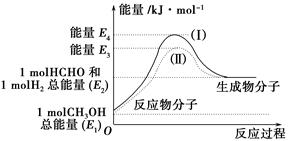
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是____________ ______________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式______________ _____________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+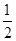 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。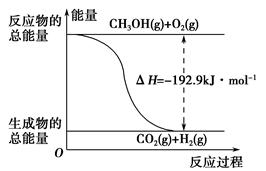
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+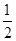 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%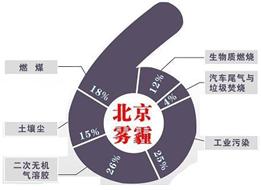
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |

 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示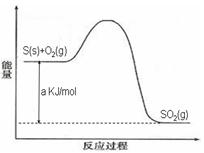
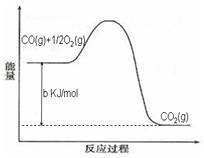
则用SO2除去CO的热化学方程式为 _____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。(4)利用ClO2氧化氮氧化物反应过程如下:

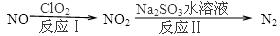
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。
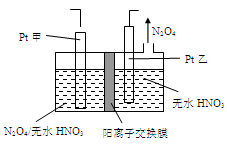
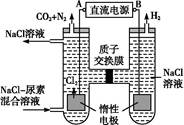
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 _____极,电解池中生成N2O5的电极反应式是________________。
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题: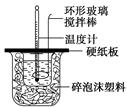
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=______ __。根据计算结果,写出该中和反应的热化学方程式_______________________________。

 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。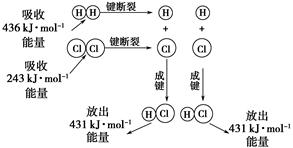
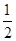 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中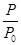 与时间t的关系如图所示。
与时间t的关系如图所示。