题目内容
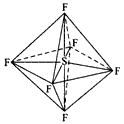
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是
A. 六氟化硫不能燃烧
B. 六氟化硫中各原子均达到8电子稳定结构
C. 六氟化硫在水中的溶解度>六氟化硫在CS2中的溶解度
D. 六氟化硫分子是极性分子
【答案】A
【解析】A.SF6中F为-1价,则S为+6价,S元素不能再失电子,所以不能被氧化,则六氟化硫不易燃烧生成二氧化硫,故A正确;B.根据图片知,每个F原子和S原子形成一对共用电子对,每个S原子和六个F原子形成六对共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层达到12电子,故B错误;C.六氟化硫分子是非极性分子,水是极性溶剂,CS2是非极性溶剂,根据相似相溶原理,六氟化硫在水中的溶解度小于六氟化硫在CS2中的溶解度,故C错误;D.该分子为正八面体结构,正负电荷中心重合,为非极性分子,故D错误;故选A。

【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应。
(1)选用下图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为________。
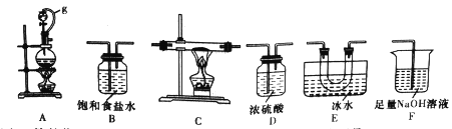
(2)图中g管的作用是______,装置E的作用是_______。
(3)开始实验时,先点燃____(填“A”或“B”)处的酒精灯。
(4)请写出BCl3遇水变质的化学方程式___________。
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是______。
(6)实验完成后,某同学向F (溶液中含有0.05 mol/LNaC10、0.05 mol/LNaCl、0.1 mol/L NaOH)中滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红溶液 | 现象 |
① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
x=_______,结论:_______________。