题目内容
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空 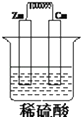
(1)锌为:极(填“正”或“负”)电极反应式为: ,
(2)反应过程中电流的方向为:
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了mol电子发生转移,铜片上产生气体的体积(标况下)为:L.
【答案】
(1)负极;Zn﹣2e﹣=Zn2+
(2)A
(3)0.02;0.224
【解析】解:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn﹣2e﹣=Zn2+ , 所以答案是:负极;Zn﹣2e﹣=Zn2+;(2)Zn易失电子作负极、Cu作正极,反应过程中电流的方向为从正极流向负极,所以答案是:A;(3)正极反应为:2H++2e﹣=H2↑,当锌片溶解0.65g时,即消耗Zn为0.01mol,转移电子为0.02mol,则铜上生成的氢气为0.01mol,在标准状况下体积为0.224L,所以答案是:0.02;0.224.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目