题目内容
15.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
分析 100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度为0.5mol/L,结合物质的构成计算氯离子的浓度,以此来解答.
解答 解:100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度为0.5mol/L,
A.100 ml 0.5 mol/L MgCl2 溶液中Cl-的物质的量浓度为0.5mol/L×2=1mol/L,故A不选;
B.200 ml 0.25 mol/L HCl溶液中Cl-的物质的量浓度为0.25mol/L,故B不选;
C.50 ml 1mol/L NaCl溶液中Cl-的物质的量浓度为1mol/L,故C不选;
D.200 ml 0.25 mol/L CaCl2溶液中Cl-的物质的量浓度为0.25mol/L×2=0.5mol/L,故D选;
故选D.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量浓度的计算方法及物质构成为解答的关键,侧重分析与计算能力的考查,注意溶液体积为干扰数据,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列图示实验操作正确的是( )
| A. |  除去CL2中的HCL | B. |  电解制CL2和H2 | C. | 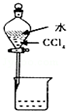 分离CCL4和水 | D. |  中和热的测定 |
6.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
3.下列物质(或主要成分)的化学式错误的是( )
| A. | 重晶石:BaSO4 | B. | 熟石膏:CaSO4•2H2O | ||
| C. | 皓矾:ZnSO4•7H2O | D. | 明矾:KAl(SO4)2•12H2O |
10.已知:H2S在与不足量的O2反应时,生成S和H2O.根据以下三个热化学方程式:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1
2H2S(g)+O2(g)═2S(s)+2H2O(l)△H2
2H2S(g)+O2(g)═2S(s)+2H2O(g)△H3
判断△H1、△H2、△H3三者大小关系正确的是( )
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1
2H2S(g)+O2(g)═2S(s)+2H2O(l)△H2
2H2S(g)+O2(g)═2S(s)+2H2O(g)△H3
判断△H1、△H2、△H3三者大小关系正确的是( )
| A. | △H3>△H2>△H1 | B. | △H1>△H3>△H2 | C. | △H1>△H2>△H3 | D. | △H2>△H1>△H3 |
20.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的水分子数为NA | |
| B. | 标准状况下,22.4 L的任何物质的物质的量都约是1 mol | |
| C. | 通常状况下,11.2LCO2的分子数为0.5NA | |
| D. | 常温常压下,0.62g Na2O含有的Na+离子数为0.02 NA |
7.下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )
| A. | Fe→FeCl3→FeCl2 | B. | Na2O2→NaOH→Na2CO3 | ||
| C. | H2→NH3→H2O | D. | S→SO3→H2SO4 |
5.下列关于84消毒剂(主要成分是NaClO)的使用和保存不正确的是( )
| A. | 将消毒液放在阴凉、避光的地方 | |
| B. | 84消毒剂也可用于漂白 | |
| C. | 在使用时,要适当稀释,消毒液不是越浓越好 | |
| D. | 可与洁厕剂(含有盐酸)混合使用 |
