题目内容
19.氢化铵(NH4H)与氯化铵的结构相似,已知NH4H与水反应有H2生成,下列叙述不正确的是( )| A. | NH4H是离子化合物,含有离子键和共价键 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H与水反应时,NH4H是氧化剂 | |
| D. | 将NH4H固体投入少量水中,有两种气体产生 |
分析 NH4H与水反应有H2生成,则NH4H中-1价的H升高为0,水中H由+1价降低为0,NH4H为铵根离子与氢负离子形成的离子化合物,以此来解答.
解答 解:A.NH4H为铵根离子与氢负离子形成的离子化合物,铵根离子中N、H之间还形成共价键,故A正确;
B.由信息可知,溶于水与水反应生成一水合氨,溶液显碱性,故B正确;
C.反应时,NH4H中-1价的H升高为0,则NH4H是还原剂,故C错误;
D.将NH4H固体投入少量水中,有两种气体产生,为氨气和氢气,故D正确;
故选C.
点评 本题考查氧化还原反应,为高考常见考点,侧重氧化还原反应迁移应用能力的考查,明确反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
9.下列措施能减慢化学反应速率的是( )
| A. | 烧煤时将煤块粉碎 | |
| B. | 用锌粉替代锌粒与同浓度同体积的盐酸反应制氢气 | |
| C. | 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 | |
| D. | 将食物贮藏在冰箱中 |
10.根据能量变化示意图,下列热化学方程式正确的是( )


| A. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-(a+b)kJ•mol-1 | B. | 2H2O(g)═2H2(g)+O2(g)△H=2(b-a)kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=(b+c-a)kJ•mol-1 | D. | H2O(g)═H2O(l)△H=ckJ•mol-1 |
14.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙醇(乙酸) | CaO | 蒸馏 |
| D | C17H35COONa(甘油) | NaCl | 分液 |
| A. | A | B. | B | C. | C | D. | D |
2.下列各说法正确的是( )
| A. | 电解精炼铜,阴极析出32g铜时,转移电子数一定大于NA | |
| B. |  图中K与M相连时,向U形试管中滴加铁氰化钾溶液,会在铁棒附件看到蓝色沉淀 | |
| C. | 金属铝很活泼,工业制备只能用电解熔融AlCl3的方法制备 | |
| D. | 电镀铜,阴、阳极质量差值增大6.4g时,转移电子为0.1NA |
9.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,下列说法错误的是( )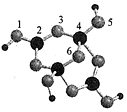

| A. | 在Xm-中,硼原子轨道的杂化类型有sp2、sp3 | |
| B. | 配位键存在于4、5原子之间 | |
| C. | m=3 | |
| D. | 硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有共价键、范德华力、氢键 |
6.含有非极性键的离子化合物是( )
| A. | Na2O2 | B. | NaOH | C. | H2 | D. | HC1 |
7.下列关于锌铜原电池的说法中正确的是( )


| A. | 电流由锌片流到铜片 | |
| B. | 铜片上产生大量气泡并且铜片不断减少 | |
| C. | 锌片上发生失电子的还原反应 | |
| D. | 这是一个将化学能转变为电能的装置 |
 ②
② ③
③