题目内容
【题目】工业上制取氯酸钾的主要步骤为:
I.将C12通入石灰浆,充分反应后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
步骤I存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
(1)①标出反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 中电子转移的方向和数目
② 滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]___________l:5(填“>”、“<”或“=”),理由是___________ 。(请用有关反应和必要的文字进行说明)
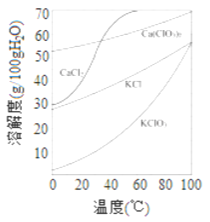
(2)上图是有关物质的溶解度曲线. 步骤II中,若溶液中KClO3的含量为100g·L-1,从该溶液中尽可能多地析出KClO3 固体的方法是______________。
【答案】(1)① 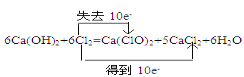
②< 同时还发生反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)蒸发浓缩、冷却结晶
【解析】
试题分析:(1)①在6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O反应中,Cl2中Cl元素一部分的化合价由0价升高到+5价,升高了5价,一部分的化合价由0价降低到-1价,降低了1价,根据化合价升降相等配平,则电子转移的方向和数目表示为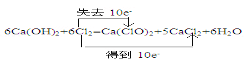 。
。
②因为化学反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O发生的同时,还发生反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;所以滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2] < l : 5。
(2)根据物质的溶解度曲线可知,KClO3 的溶解度随温度的变化较大,则从该溶液中尽可能多地析出KClO3 固体的方法是蒸发浓缩、冷却结晶。

 优学名师名题系列答案
优学名师名题系列答案