题目内容
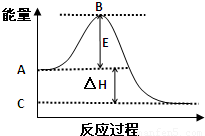
(1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
请回答下列问题:
①图中A点表示:______
C点表示:______
E的大小对该反应的反应热______(填“有”或“无”)影响.
②图中△H=______kJ/mol.
(2)(4分)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得)
①写出该反应的热化学方程式:______
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+
O2(g)=H2O(l)的△H=______kJ/mol.氢气的燃烧热为△H=______kJ/mol.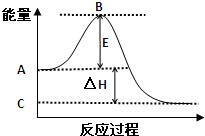
请回答下列问题:
①图中A点表示:______
C点表示:______
E的大小对该反应的反应热______(填“有”或“无”)影响.
②图中△H=______kJ/mol.
(2)(4分)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得)
①写出该反应的热化学方程式:______
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+
| 1 |
| 2 |

(1)①因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无;
②因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(2)①生成1mol水需要0.5molO2,反应的热化学方程式为H2(g)+
O2(g)=H2O(g)△H=-241.8 kJ?mol-1,
故答案为:H2(g)+
O2(g)=H2O(g)△H=-241.8 kJ?mol-1.
②1mol水蒸气转化为液态水放热45kJ,根据盖斯定律可知反应H2(g)+
O2(g)=H2O(l)的△H=-(241.8+45)=-286.8 kJ?mol-1,所以氢气的燃烧热为△H=-286.8 kJ?mol-1,故答案为:-286.8;-286.8.
故答案为:反应物总能量;生成物总能量;无;
②因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(2)①生成1mol水需要0.5molO2,反应的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
②1mol水蒸气转化为液态水放热45kJ,根据盖斯定律可知反应H2(g)+
| 1 |
| 2 |

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 (1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
(1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol. O2(g)=H2O(l)的△H=______kJ/mol.氢气的燃烧热为△H=______kJ/mol.
O2(g)=H2O(l)的△H=______kJ/mol.氢气的燃烧热为△H=______kJ/mol.