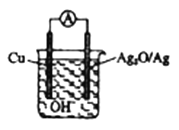
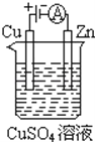
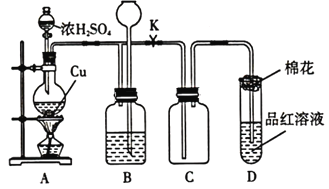
题目内容
【题目】下列各性质中符合图示关系的是
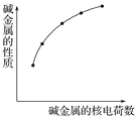
①化合价 ②ROH的碱性 ③密度 ④最外层电子数 ⑤核外电子层数 ⑥单质失e-能力
A.②④⑤⑥B.②⑤⑥C.②③⑤⑥D.①②③⑤
【答案】B
【解析】
从表中可以看出,随着碱金属核电荷数的依次增大,碱金属的某性质依次增强。
①碱金属元素单质的化合价都为0价,①不合题意;
②随着碱金属核电荷数的依次增大,ROH的碱性依次增强,②符合题意;
③总的来说,随着碱金属核电荷数的依次增大,碱金属单质的密度依次增大,但钾的密度比钠小,出现反常,③不合题意;
④碱金属原子的最外层电子数都为1,不随碱金属核电荷数的增大而增大,④不合题意;
⑤随着碱金属核电荷数的依次增大,核外电子层数依次增多,⑤符合题意;
⑥随着碱金属核电荷数的依次增大,单质失e-能力增强,⑥符合题意。
综合以上分析,②⑤⑥符合题意。故选B。

练习册系列答案
相关题目
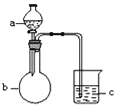
【题目】用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
选项 | a | b | c | 现象 | 结论 | 装置 |
A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 |
|
B | 浓盐酸 | MnO2 | 石蕊试液 | 石蕊试液先变红后褪色 | 氯气具有漂白性 | |
C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH溶液反应 |
A.AB.BC.CD.D