题目内容
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
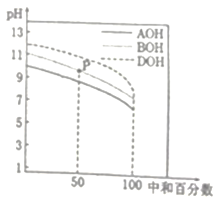
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
【答案】D
【解析】试题分析:三种碱的起始浓度均为0.1mol/L,由图中信息可知,起始时pH都小于13,说明三种碱均为弱碱,且碱性强弱为AOH<BOH<DOH,碱性越强,对水的电离的抑制作用越大。在相同条件下,盐水解的程度由小到大的顺序是DCl<BCl<ACl,它们水解均使溶液显酸性。A.滴定前,三种碱液中水电离的c(H+)大小关系为AOH>BOH>DOH,A不正确;B.滴定至P点时,此时中和百分数为50%,即BOH恰好有一半被中和,溶液为物质的量浓度相同的BOH和BCl混合溶液,pH>7、溶液显碱性,则BOH的电离程度大于BCl的水解程度,所以溶液中c(Cl-)<c(B+), B不正确;C.pH=7时,溶液中c(H+)=c(OH﹣),由电荷守恒可知,三种溶液中c(Cl-)均等于其c(弱碱的阳离子)。由于三种盐在相同的条件下的水解程度由小到大的顺序是DCl<BCl<ACl,且其水解均使溶液显酸性,则滴定到溶液恰好呈中性时,三种溶液中消耗HCl的体积由小到大的顺序为AOH<BOH<DOH,则三种溶液中c(Cl﹣)不相等,且c(Cl﹣)由小到大的顺序为AOH<BOH<DOH,因而c(A+)<c(B+)<c(D+),故C不正确;D.当中和百分数达100%时,三种溶液的物质的量浓度相同,混合后,根据质子守恒,c(DOH)+c(AOH)+c(BOH)+c(OH﹣)=c(H+),则c(AOH)+c(BOH)+c(DOH)=c(H+)﹣c(OH﹣),故D正确。本题选D。

 阅读快车系列答案
阅读快车系列答案