题目内容
(附加题)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C-比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子.回答下列问题:(1)A、B、C、D四种元素的名称分别是______、______、______、______;
(2)C-的结构示意图为______;D元素在周期表中的位置是______;
(3)元素D的气态氢化物的电子式为______,其分子的结构特点是具有______结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为______ Mg+Cl2↑
【答案】分析:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=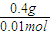 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.
解答:解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=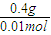 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,
(1)综上所述,A为镁,B为铝,C为氯;D为碳,故答案为:镁;铝;氯;碳;
(2)Cl的质子数为17,离子结构示意图为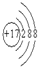 ,C元素位于元素周期表中第二周期、ⅣA,故答案为:
,C元素位于元素周期表中第二周期、ⅣA,故答案为: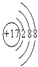 ;第二周期、ⅣA;
;第二周期、ⅣA;
(3)D的气态氢化物为甲烷,其电子式为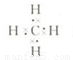 ,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为:
,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为: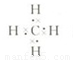 ;正四面体;HCl;
;正四面体;HCl;
(4)工业上利用电解熔融的氯化镁来冶炼Mg,电解反应为MgCl2(熔融) Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) Mg+Cl2↑;
Mg+Cl2↑;
(5)工业上利用铝热反应来冶炼难熔的金属,Al与氧化铁的反应为Fe2O3+2Al Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023,
Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023,
故答案为:Fe2O3+2Al Al2O3+3Fe;放热;13.5g;9.03×1023;
Al2O3+3Fe;放热;13.5g;9.03×1023;
(6)Mg、Al与NaOH溶液构成原电池,Al为负极,正极为Mg,负极反应为2Al-6e-+8OH-=2AlO2-+3H2↑,
故答案为:Mg;2Al-6e-+8OH-=2AlO2-+3H2↑.
点评:本题考查位置、结构、性质及其应用,难度较大,综合性较强,熟悉化学用语及金属的冶炼、原电池即可解答,元素的推断是解答的难点.
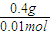 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,并利用元素及其单质、化合物的性质来解答.解答:解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=
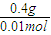 =40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外第三层电子数目比第一层多1个,最外层电子数为3,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素的原子核外第二层比第一层多2个电子,则第二层电子数为4,即D为C元素,(1)综上所述,A为镁,B为铝,C为氯;D为碳,故答案为:镁;铝;氯;碳;
(2)Cl的质子数为17,离子结构示意图为
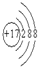 ,C元素位于元素周期表中第二周期、ⅣA,故答案为:
,C元素位于元素周期表中第二周期、ⅣA,故答案为: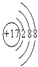 ;第二周期、ⅣA;
;第二周期、ⅣA;(3)D的气态氢化物为甲烷,其电子式为
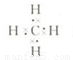 ,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为:
,空间结构为正四面体型,甲烷与氯气发生取代反应,发生一氯取代、二氯取代、三氯取代、四氯取代都生成HCl,则等物质的量的甲烷与氯气混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl,故答案为: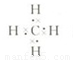 ;正四面体;HCl;
;正四面体;HCl;(4)工业上利用电解熔融的氯化镁来冶炼Mg,电解反应为MgCl2(熔融)
 Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) Mg+Cl2↑;
Mg+Cl2↑;(5)工业上利用铝热反应来冶炼难熔的金属,Al与氧化铁的反应为Fe2O3+2Al
 Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023,
Al2O3+3Fe,该反应属于放热反应,由方程式可知反应中有0.25mol氧化铁参加反应,则消耗Al的物质的量为0.25mol×2=0.5mol,其质量为0.5mol×27g/mol=13.5g,由Al元素的化合价变化可知反应中转移电子的个数为0.5mol×(3-0)×NA=9.03×1023,故答案为:Fe2O3+2Al
 Al2O3+3Fe;放热;13.5g;9.03×1023;
Al2O3+3Fe;放热;13.5g;9.03×1023; (6)Mg、Al与NaOH溶液构成原电池,Al为负极,正极为Mg,负极反应为2Al-6e-+8OH-=2AlO2-+3H2↑,
故答案为:Mg;2Al-6e-+8OH-=2AlO2-+3H2↑.
点评:本题考查位置、结构、性质及其应用,难度较大,综合性较强,熟悉化学用语及金属的冶炼、原电池即可解答,元素的推断是解答的难点.

练习册系列答案
相关题目





 2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是
2ZX3(g),在一定温度下的定容容器中,下列事实不能说明该反应已经达到平衡的标志的是
