题目内容
3.一定温度下,10mL 0.4mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如表:| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6 min时,c(H2O2)=0.20mol/L | |
| B. | 反应至6 min时,H2O2分解了40% | |
| C. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol•L-1•min-l | |
| D. | 6~10 min的平均反应速率:可(H2O2)<3.3×10-2mol•L-1•min-l |
分析 A.由氧气的体积及反应可知6min内过氧化氢浓度变化量,6min时的浓度=起始浓度-浓度变化量;
B.H2O2分解率=(H2O2浓度变化量÷H2O2起始浓度)×100%;
C.0~6min时间内,生成氧气为$\frac{0.0224L}{22.4L/mol}$=0.001mol,则△c(H2O2)=$\frac{0.002mol}{0.01L}$=0.2mol/L,根据v=$\frac{△c}{△t}$计算v(H2O2);
D.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,小于0~6min时间内反应速率.
解答 解:A.由表格数据及2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可知,反应至6 min时c(H2O2)=0.4mol/L-0.2mol/L=0.2mol/L,故A正确;
B.6min内△c(H2O2)=0.2mol/L,则H2O2分解率为$\frac{0.2mol/L}{0.4mol/L}$×100%=50%,故B错误;
C.0~6min时间内,生成氧气为$\frac{0.0224L}{22.4L/mol}$=0.001mol,由2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,△c(H2O2)=$\frac{0.002mol}{0.01L}$=0.2mol/L,则v(H2O2)=$\frac{0.2mol/L}{6min}$≈0.033mol/(L•min),故C正确;
D.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,4~6 min的平均反应速率小于0~6min时间内反应速率,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据的应用、反应中物质的量关系、速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的易错点,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 电解冶炼铝时产生副产物不处理可导致温室效应 | |
| B. | 粗硅制高纯硅时,提纯四氯化硅可用过滤、分馏的方法 | |
| C. | 黄铜矿冶铜时,将矿石粉碎以提高生产效率 | |
| D. | 上述生产过程既涉及氧化还原反应,又涉及非氧化还原反应 |
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I2 |
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3OH | D. | CH3-O-CH3 |
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
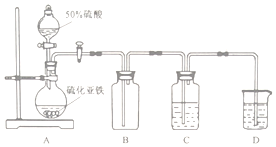
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).

| A. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| B. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z、N两种元素的离子半径相比,前者较大 |
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 放电时负极反应式为:Li-e-+Cl-=LiCl | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
| A. | NH3 | B. | CO | C. | H2S | D. | SO2 |
| A. | 甘蔗渣可经化学反应制得酒精 | |
| B. | 棉花、蚕丝和人造丝的主要成分都是纤维素 | |
| C. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| D. | 不能用米汤检验食用碘盐中的碘酸钾 |