题目内容
7. 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1mol•L-1的氨水中加入少量NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量明矾,溶液中铵根离子的浓度最大(填“增大”或“减小”).
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑,平衡常数表达式为Kc(N2O)×c2(2H2O);
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,写出热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•mol-1.
分析 (1)一水合氨为弱碱,溶于水存在部分电离,依据化学平衡原理解释加入NH4Cl固体以及明矾后平衡移动方向以及pH的变化;
(2)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式;
(3)由图可知,此反应为放热反应,热效应=(209-348)kJ•mol-1.
解答 解:(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,电离方程式为:NH3•H2O?NH4++OH-;
向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低;
加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,NH4+浓度增大,
故答案为:NH3•H2O?NH4++OH-;降低;增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(2H2O),
故答案为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;c(N2O)×c2(2H2O);
(3)由图可知,此反应反应物总能量高于生成物,则该反应的焓变△H=209-348=-139kJ•mol-1,该反应的热化学方程式为:N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139 kJ•mol-1,
故答案为:N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139 kJ•mol-1.
点评 本题考查了弱电解质的电离、热化学方程式的书写等知识,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 2NaOH+Cl2═NaCl+NaClO+H2O | B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | 2FeCl3+Fe═3FeCl2 | D. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CO2+CaO |
| A. | 将w g a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| B. | 将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的物质的量浓度为0.2c mol/L | |
| C. | 将5.85 g NaCl晶体溶于水配成1L溶液,制得0.01 mol/L的NaCl溶液 | |
| D. | 1 mol•L-1 AlCl3溶液中Cl-的物质的量浓度与3 mol•L-1NH4Cl溶液中Cl-的物质的量浓度相等 |
| A. | K | B. | Ca | C. | Na | D. | F |
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
| A. | 含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- | |
| B. | 中性溶液:Fe3+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 常温下,pH=12的溶液:Na+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 与铝粉反应放出H2的无色溶液:Br-、Al3+、Na+、SO${\;}_{4}^{2-}$ |
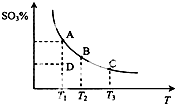 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )| A. | 在D点时v正>v逆 | |
| B. | 其他条件不变,增大氧气的浓度可以提高二氧化硫的转化率 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒容下向平衡体系中通入氦气,平衡向右移动 |