��Ŀ����
A��B��C����Ԫ�����ڱ��еĶ����ڷǽ���Ԫ�أ����ǵĺ˵������������Aԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������2����Bԭ�ӵ������p����ĵ���Ϊ�����ṹ��C�ǵؿ��к�������Ԫ�ء�D��E�ǵ�������Ԫ�أ�Dԭ�Ӻ���������������1�����ӣ����������Ӿ�������Eԭ�Ӻ���δ�ɶԵ�������ͬ��������ࡣ���ö�Ӧ��Ԫ�ط��Ż�ѧʽ��գ�
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ �� A��C���⻯��е��С��ϵΪ������������������ԭ��Ϊ������������������������������������������������
����������������������������������������������������������������������������
��2��D��E��ԭ�ӻ��ȷֱ�Ϊ340 kJ��mol-1��400kJ��mol-1�������ǵ��۵㣺D E(�����������������="��" )��
��3������A2B2�м����֮��ļн�Ϊ180�㣬���жԳ��ԣ�Ϊ�Ǽ��Է��ӣ�ÿ��ԭ������������������˵��ӣ���ṹʽΪ_____________��1mol�÷����к���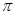 ������ĿΪ ��
������ĿΪ ��
��4����̬��ԭ�ӵ���Χ�����Ų�ʽΪ ��EO2Cl2�۵㣺��96 .5�棬�е㣺117�棬���̬EO2Cl2���� ���塣
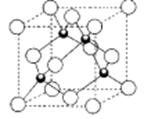
��5��D���⻯��ľ���ṹ��ͼ��ʾ���仯ѧʽ�� ��
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ �� A��C���⻯��е��С��ϵΪ������������������ԭ��Ϊ������������������������������������������������
����������������������������������������������������������������������������
��2��D��E��ԭ�ӻ��ȷֱ�Ϊ340 kJ��mol-1��400kJ��mol-1�������ǵ��۵㣺D E(�����������������="��" )��
��3������A2B2�м����֮��ļн�Ϊ180�㣬���жԳ��ԣ�Ϊ�Ǽ��Է��ӣ�ÿ��ԭ������������������˵��ӣ���ṹʽΪ_____________��1mol�÷����к���
 ������ĿΪ ��
������ĿΪ ����4����̬��ԭ�ӵ���Χ�����Ų�ʽΪ ��EO2Cl2�۵㣺��96 .5�棬�е㣺117�棬���̬EO2Cl2���� ���塣
��5��D���⻯��ľ���ṹ��ͼ��ʾ���仯ѧʽ�� ��

��C��O��N��1�֣���H2O��CH4����1�֣� H2O���Ӽ���ڷ��Ӽ��������H2OΪ���Է��ӣ�2�֣���
��<��1�֣���N��C��C��N��2�֣�4NA����2.408��1024����2�֣�
��3d54s1��1�֣� ���ӣ�1�֣�
��CuH��2�֣�
��<��1�֣���N��C��C��N��2�֣�4NA����2.408��1024����2�֣�
��3d54s1��1�֣� ���ӣ�1�֣�
��CuH��2�֣�
���������Aԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������2������A�ĵ����Ų�Ϊ1s22s1��1s22s22p2ΪLi��C��Bԭ�ӵ������p����ĵ���Ϊ�����ṹ����s2p3�ṹ��ΪN��P��C�ǵؿ��к�������Ԫ��ΪO����A��B��C����Ԫ�����ڱ��еĶ����ڷǽ���Ԫ�أ����ǵĺ˵������������ABC�ֱ�ΪC��N��O��D��E�ǵ�������Ԫ�أ�Dԭ�Ӻ���������������1�����ӣ����������Ӿ������������Ų�Ϊ[Ar]3d104s1��ΪCu��Eԭ�Ӻ���δ�ɶԵ�������ͬ��������࣬ӦΪ3d54s1��ΪCrԪ�أ��ʣ�1��A��B��C�ĵ�һ��������С�����˳��ΪC��O��N��A��C���⻯��е��С��ϵΪH2O��CH4����ΪH2O���Ӽ���ڷ��Ӽ��������H2OΪ���Է��ӣ���2��D��ԭ�ӻ��ȣ�E��ԭ�ӻ��ȹ��۵㣺D ��E����3������A2B2�м����֮��ļн�Ϊ180�㣬���жԳ��ԣ�Ϊ�Ǽ��Է��ӣ�ÿ��ԭ������������������˵��ӣ���ṹʽΪN��C��C��N��
 ������ĿΪ4����1mol�÷����к���
������ĿΪ4����1mol�÷����к��� ������ĿΪ4NA����4����̬��ԭ�ӵ���Χ�����Ų�ʽΪ3d54s1�����������ʣ���֪��̬CrO2Cl2���ڷ��Ӿ��壻��5�����ݾ����ṹ��֪����Hԭ�Ӹ���Ϊ4��Cuԭ�Ӹ���Ϊ8��1/8+6��1/2=4���ʻ�ѧʽΪCuH��
������ĿΪ4NA����4����̬��ԭ�ӵ���Χ�����Ų�ʽΪ3d54s1�����������ʣ���֪��̬CrO2Cl2���ڷ��Ӿ��壻��5�����ݾ����ṹ��֪����Hԭ�Ӹ���Ϊ4��Cuԭ�Ӹ���Ϊ8��1/8+6��1/2=4���ʻ�ѧʽΪCuH��
��ϰ��ϵ�д�
 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д�
�����Ŀ
 NaClO3��Һ
NaClO3��Һ KClO3����
KClO3����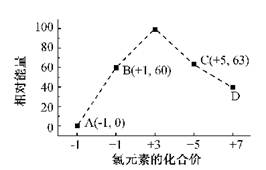
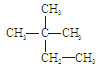 �۰��� ��18O ��
�۰��� ��18O ��