题目内容
2.下列物质所形成的晶体中阴阳离子的个数比为1:1的是( )| A. | Na2O2 | B. | NaHSO4 | C. | HCl | D. | H2O |
分析 A.Na2O2晶体中是O22-一个离子;
B.硫酸氢钠固体中其阴阳离子分别是硫酸氢根离子、钠离子;
C.HCl为分子晶体,无阴阳离子;
D.H2O为分子晶体,无阴阳离子.
解答 解:A.Na2O2晶体中含有一个O22-和两个Na+,所以Na2O2晶体中阴阳离子个数比是1:2,故A错误;
B.硫酸氢钠固体中其阴阳离子分别是硫酸氢根离子、钠离子,所以NaHSO4固体中阳离子和阴离子的个数比是1:1,故B正确;
C.分子晶体只存在分子,HCl为分子晶体,无阴阳离子,故C错误;
D.H2O为分子晶体,无阴阳离子,故D错误;
故选B.
点评 本题考查了晶体的构成、化学键等,属于基础知识的考查,明确硫酸氢钠熔融状态和在水溶液里电离方式的区别是解本题关键,此点为考试热点,也是学生易错点,题目难度不大.

练习册系列答案
相关题目
13.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
10.从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
| A. | ①、③是置换反应,②是化合反应 | |
| B. | 高温下,焦炭与氢气的还原性均弱于硅 | |
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 | |
| D. | 在第三个反应中,SiCl4作氧化剂 |
17.用现有三组溶液:①汽油和氯化钠溶液 ②汽油和柴油的混合物 ③从氯化钠和单质碘的水溶液中分离出碘,分离以上物质正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
11.已知: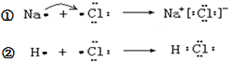 下列说法不正确的是( )
下列说法不正确的是( )
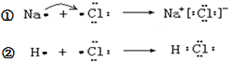 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
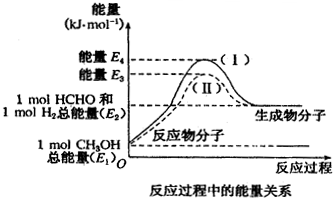
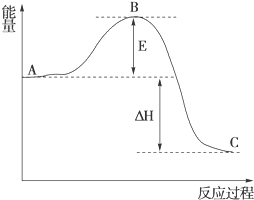
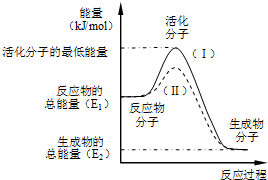 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是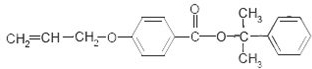 .
.
 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.