题目内容
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价电层电子均已成对。
回答下列问题:
(1)E2+的价层电子排布图为________________。
(2)五种元素中第一电离能最小的是________(填元素符号),CAB-离子中,A原子的杂化方式是________。
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有________________,该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。

①该化合物的化学式为________,E的配位数为________,C采取________(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积;
②列式表示该晶体的密度:________g·cm-3。
【答案】(1) ![]()
(2)K sp杂化
(3)共价键、配位键、离子键 [Zn(CN)4]2- CN-
(4)①ZnS 4 六方最密
②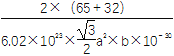
【解析】(1)因E在ds区且基态原子均成对可知E为Zn,失去4s能级层上的两个电子得Zn2+。(2)由题意可知A为C,B为N,C为S,D为K,其中第一电离能最小的即金属性最强的为K;在SCN-中C形成两个σ键两个π键,为sp杂化。(3)K2Zn(CN)4中含有离子键和共价键,而Zn2+存在空轨道,与CN-形成配位键。(4)①根据均摊原理知其化学式为ZnS,由图中虚线连接可知Zn的配位数为4,S采取六方最密堆积;②晶胞的体积V=a×![]() ×a×b×10-30cm3,所以密度ρ=
×a×b×10-30cm3,所以密度ρ=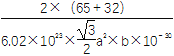 g·cm-3。
g·cm-3。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案