题目内容
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
 ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
(1) 在450℃时,2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为190 kJ;变小
(2) bd 4分 (3) 0.036 向正反应方向 0.36 0.40
(2) bd 4分 (3) 0.036 向正反应方向 0.36 0.40
(1)考查热化学方程式的意义。根据反应的热化学方程式可知,在450℃时,2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为190 kJ。反应是放热反应,升高温度平衡向逆反应方向移动,所以平衡常数变小。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率方向相反,但不满足速率之比是相应但化学计量数之比,不正确。气体的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以bd都可以说明。气体的密度是混合气的质量和容器容积的比值,质量和容积均是不变的,所以密度始终是不变的,c不正确。答案选bd。
(3)容器中含SO3 0.18 mol,则消耗越强就是0.09mol,因此氧气的反应速率是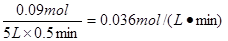 。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率方向相反,但不满足速率之比是相应但化学计量数之比,不正确。气体的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以bd都可以说明。气体的密度是混合气的质量和容器容积的比值,质量和容积均是不变的,所以密度始终是不变的,c不正确。答案选bd。
(3)容器中含SO3 0.18 mol,则消耗越强就是0.09mol,因此氧气的反应速率是
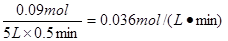 。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
 2Z,其平衡常数为1600
2Z,其平衡常数为1600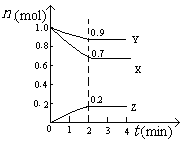
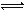 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是( )
Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是( ) CH3OH(g) ΔH=-90.7 kJ/mol):
CH3OH(g) ΔH=-90.7 kJ/mol):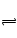 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题: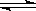 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”), (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”); C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是  nC(s)+D(g)达平衡。若维持温度不变,增大压强,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
nC(s)+D(g)达平衡。若维持温度不变,增大压强,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )