题目内容
(8分)往容积为10L的密闭容器内通入40molN2和120molH2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2mol/L。
(1)用H2的浓度变化表示2s内的平均速率为 。
(2) 氮气的转化率是 。
(3) 平衡时混合气体中氨的体积分数是 。
(4) 容器内反应前后压强比是 。
(1)用H2的浓度变化表示2s内的平均速率为 。
(2) 氮气的转化率是 。
(3) 平衡时混合气体中氨的体积分数是 。
(4) 容器内反应前后压强比是 。
(1)3mol/(L·S) (2)50% (3)33.3% (4)4∶3
考查可逆反应的有关计算,一般采用三段式。
N2 + 3H2 2NH3
2NH3
起始量(mol) 40 120 0
转化量(mol) 20 60 40
平衡量(mol) 20 60 40
(1)用H2的浓度变化表示2s内的平均速率为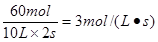
(2)氮气的转化率是20÷40×100%=50%
(3)平衡时混合气体中氨的体积分数是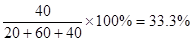
(4)容器内反应前后压强比是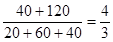
N2 + 3H2
 2NH3
2NH3 起始量(mol) 40 120 0
转化量(mol) 20 60 40
平衡量(mol) 20 60 40
(1)用H2的浓度变化表示2s内的平均速率为
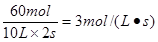
(2)氮气的转化率是20÷40×100%=50%
(3)平衡时混合气体中氨的体积分数是
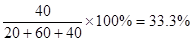
(4)容器内反应前后压强比是
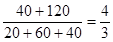

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
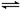 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是 xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为
xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表: CO2+1/2N2,则100℃时,K的值= 。
CO2+1/2N2,则100℃时,K的值= 。 mZ(g) ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是( )
mZ(g) ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是( )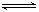 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为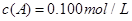 、
、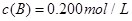 及
及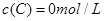 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。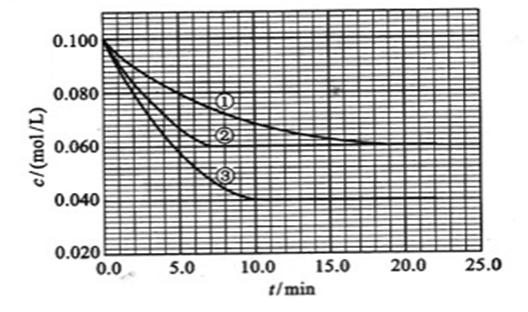
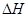 _________0,判断其理由是__________ __
_________0,判断其理由是__________ __