题目内容
【题目】W是由A、B两种元素组成的AB2型化合物.
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.则W为(填化学式).
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象. 往另一支试管中加入足量氯水,再加入适量CCl4 , 振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色.
①W溶液中所含金属阳离子为
②上述实验中,W与足量氯水反应的离子方程式为:
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1. ①阴离子的电子式为 .
②1mol W与足量水充分反应,转移电子的物质的量为mol
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸. ①B在元素周期表中的位置为
②如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为:
(5)若如图表示0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化.则该反 应的热化学方程式为: . 
【答案】
(1)SiO2
(2)Fe2+;2Fe2++4I﹣+3Cl2=2Fe3++I2+6Cl﹣
(3)![]() ;1
;1
(4)第二周期VIA族;H2SeO3+H2O2=H2SeO4+H2O
(5)NO2(g)+CO(g)=CO2(g)+NO(g)△H=2(E1﹣E2)KJ/mol
【解析】解:(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2 , 该反应方程式为:2C+SiO2 ![]() Si+2CO↑, 所以答案是:SiO2 ;(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+ , 往另一支试管中加入足量氯水,再加入适量CCl4 , 振荡,静置,下层溶液呈紫红色,说明W含有I﹣ , 往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+ , 故W为FeI2 . ①W溶液中所含金属阳离子为:Fe2+ , 所以答案是:Fe2+; ②W(FeI2)与足量氯水反应的离子方程式为:2Fe2++4I﹣+3Cl2=2Fe3++I2+6Cl﹣ ,
Si+2CO↑, 所以答案是:SiO2 ;(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+ , 往另一支试管中加入足量氯水,再加入适量CCl4 , 振荡,静置,下层溶液呈紫红色,说明W含有I﹣ , 往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+ , 故W为FeI2 . ①W溶液中所含金属阳离子为:Fe2+ , 所以答案是:Fe2+; ②W(FeI2)与足量氯水反应的离子方程式为:2Fe2++4I﹣+3Cl2=2Fe3++I2+6Cl﹣ ,
所以答案是:2Fe2++4I﹣+3Cl2=2Fe3++I2+6Cl﹣; (3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2 . ①CaO2中阴离子的电子式为: ![]() ,所以答案是:
,所以答案是: ![]() ; ②发生反应:2CaO2+2H2O=2Ca(OH)2+O2↑,反应中CaO2既是氧化剂又是还原剂,1mol CaO2与足量水充分反应生成0.5mol氧气,转移电子的物质的量为0.5mol×2=1mol,所以答案是:1;(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;①氧元素处于周期表中第二周期VIA族,所以答案是:第二周期VIA族;②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2 , SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O,
; ②发生反应:2CaO2+2H2O=2Ca(OH)2+O2↑,反应中CaO2既是氧化剂又是还原剂,1mol CaO2与足量水充分反应生成0.5mol氧气,转移电子的物质的量为0.5mol×2=1mol,所以答案是:1;(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;①氧元素处于周期表中第二周期VIA族,所以答案是:第二周期VIA族;②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2 , SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O,
所以答案是:H2SeO3+H2O2=H2SeO4+H2O;(5)0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g),碳元素化合价+2价升高到+4价,电子转移=0.5mol×2=1mol,则0.5molW (g)中氮元素化合价变化降低,变化过程中的电子转移=1mol=(4﹣2)×0.5mol=1mol,W为NO2 , 能量变化可知为放热反应反应焓变△H=E1﹣E2 , 1molNO2和 1molCO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H= ![]() KJ/mol/L=2(E1﹣E2)KJ/mol,
KJ/mol/L=2(E1﹣E2)KJ/mol,
所以答案是:NO2(g)+CO(g)=CO2(g)+NO(g)△H=2(E1﹣E2)KJ/mol.

 53天天练系列答案
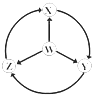
53天天练系列答案【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
A.A
B.B
C.C
D.D