题目内容
(14分)面对全球近期的气候异常,环境问题再次成为焦点。SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列措施中,有利于降低大气中的SO2、NOx、CO2浓度的有 (选填字母)。
a.减少化石燃料的使用,加快开发和利用风能、氢能等新能源
b.使用无磷洗涤用品,减少含磷废物的排放
c.多步行或乘公交车,少用专车或私家车
d.在屋顶安装太阳能热水器为居民提供生活用热水
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染。已知用合成气(CO和H2)合成1 mol液态甲醇吸收热量为131.9 kJ,2H2(g)=CO2(g)+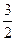 O2(g)2H2O(g)△H=—594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
O2(g)2H2O(g)△H=—594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
(3)现欲以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
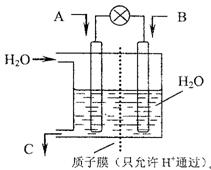
①若A为CO2,B为H2,C为CH2OH 则通入H2的一极为 极;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
(4)①已知:密闭容器中,17℃、1.01×105Pa条件下,2NO2(g) N2O4(g) △H<0的平衡常数K=13.3。当此反应达到平衡时,若c(NO2)="0.030" mol/L,则c(N2O4)= (保留两位有效数字);
N2O4(g) △H<0的平衡常数K=13.3。当此反应达到平衡时,若c(NO2)="0.030" mol/L,则c(N2O4)= (保留两位有效数字);
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是 。
(1)下列措施中,有利于降低大气中的SO2、NOx、CO2浓度的有 (选填字母)。
a.减少化石燃料的使用,加快开发和利用风能、氢能等新能源
b.使用无磷洗涤用品,减少含磷废物的排放
c.多步行或乘公交车,少用专车或私家车
d.在屋顶安装太阳能热水器为居民提供生活用热水
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染。已知用合成气(CO和H2)合成1 mol液态甲醇吸收热量为131.9 kJ,2H2(g)=CO2(g)+
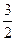 O2(g)2H2O(g)△H=—594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
O2(g)2H2O(g)△H=—594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。(3)现欲以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。

①若A为CO2,B为H2,C为CH2OH 则通入H2的一极为 极;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
(4)①已知:密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)
 N2O4(g) △H<0的平衡常数K=13.3。当此反应达到平衡时,若c(NO2)="0.030" mol/L,则c(N2O4)= (保留两位有效数字);
N2O4(g) △H<0的平衡常数K=13.3。当此反应达到平衡时,若c(NO2)="0.030" mol/L,则c(N2O4)= (保留两位有效数字);②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是 。
(1)abc …………3分
(2)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1452kJ/mol
…………3分
(3)①负 …………2分
②SO2+2H2O-2e-=SO2-4+4H+ …………2分
(4)①0.012mol/L …………2分
②升高温度 …………2分
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 研究性学习小组测定某水样的化学需氧量(COD),过程如下:
研究性学习小组测定某水样的化学需氧量(COD),过程如下: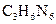 )含氮量很高,可作为牛奶添加剂
)含氮量很高,可作为牛奶添加剂