题目内容
【题目】如图A、B、C、D、E五组仪器(图中a、b、c表示止水夹)可以根据需要组装成不同实验装置.某兴趣小组的同学利用这些实验仪器进行实验,请对其方案进行完善或评价.
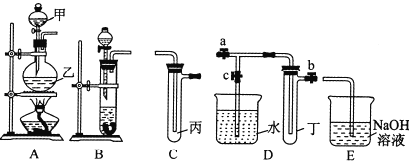
(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是 ,该实验尾气吸收装置设计有何不妥? ;改正后将B、D、E装置相连,用D装置中的丁试管收集满氯化氢气体,使烧杯中的水进入试管丁的操作是 。
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物有具有酸性 |
请你评价:实验I推出的相应的结论是否合理? ;若不合理,请说明理由,〔若合理则无需填写) 。实验Ⅱ推出的结论是否合理? ;若不合理,请说明理由,(若合理则无需填写) 。
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为 。
【答案】(1)浓硫酸,用NaOH溶液吸收氯化氢易发生倒吸;关闭分液漏斗活塞,夹紧止水夹a、b,打开止水夹c,微热试管丁,使试管中气体逸出接触烧杯中的水;(2)不合理(2分);没有实验证明干燥的氯气无漂白性;不合理;制取的氯气含有HCl,HCl溶于水后能与碳酸氢钠反应产生气泡;
(3)2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3。
【解析】
试题分析:(1)装在分液漏斗中的试剂为浓硫酸,烧瓶中盛放浓盐酸,利用浓硫酸遇水放热,浓盐酸不稳定,易挥发;氯化氢易于氢氧化钠溶液反应,容易引起倒吸,缺少防倒吸装置;关闭分液漏斗活塞,夹紧止水夹a、b,打开止水夹c,微热试管丁,使试管中气体逸出接触烧杯中的水;(2)氯水中存在:Cl2+H2O ![]() HCl+HClO,氯水中存在Cl2、HCl和HClO,没有实验证明干燥的氯气无漂白性,因此不合理;制取的氯气中混有HCl,HCl能和NaHCO3反应生成CO2,干扰实验,因此不合理;(3)NaClO3中Cl转变成ClO2 ,Cl的化合价由+5价→+4价,化合价降低1价,则Na2C2O4中C的价态由+3价→+4价,共升高2价,最小公倍数为2,环境是碱性,生成碳酸钠,因此反应方程式为2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3。
HCl+HClO,氯水中存在Cl2、HCl和HClO,没有实验证明干燥的氯气无漂白性,因此不合理;制取的氯气中混有HCl,HCl能和NaHCO3反应生成CO2,干扰实验,因此不合理;(3)NaClO3中Cl转变成ClO2 ,Cl的化合价由+5价→+4价,化合价降低1价,则Na2C2O4中C的价态由+3价→+4价,共升高2价,最小公倍数为2,环境是碱性,生成碳酸钠,因此反应方程式为2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案