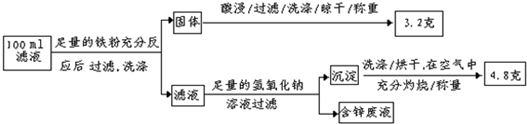
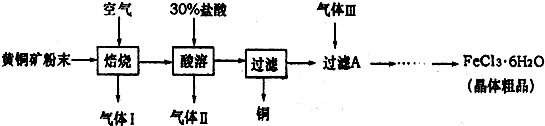
题目内容
(2013?德州模拟)硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
(1)氨气催化氧化的化学方程式为
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(3)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是
(4)制得的硝酸可以跟金属铜反应生成硝酸铜溶液,用石墨电极电解该硝酸铜溶液,则电解过程中阳极的电极反应式为
(1)氨气催化氧化的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| 加热 |
4NH3+5O2
4NO+6H2O
.
| ||
| 加热 |
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol
CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol
.(3)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2
| ||
负极
负极
(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为4NH3+12OH--12e=2N2+12H2O
4NH3+12OH--12e=2N2+12H2O
.(4)制得的硝酸可以跟金属铜反应生成硝酸铜溶液,用石墨电极电解该硝酸铜溶液,则电解过程中阳极的电极反应式为
4OH--4e-=O2+2H2O
4OH--4e-=O2+2H2O
.分析:(1)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O;
(2)根据盖斯定律来书写热化学方程式;
(3)根据燃料电池中,燃料做负极,氧气作正极,负极的电极反应=总反应-正极的电极反应;
(4)根据离子的放电顺序及反应类型书写.
(2)根据盖斯定律来书写热化学方程式;
(3)根据燃料电池中,燃料做负极,氧气作正极,负极的电极反应=总反应-正极的电极反应;
(4)根据离子的放电顺序及反应类型书写.
解答:解:(1)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据盖斯定律(①+②)×
,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,总反应:4NH3+3O2
2N2+6H2O,正极的电极反应:3O2↑+6H2O+12e-=12OH-,负极的电极反应式为:
4NH3+12OH--12e=2N2+12H2O,故答案为:负极;4NH3+12OH--12e=2N2+12H2O;
(4)Cu(NO3)2溶液中铜离子的放电能力大于氢离子的放电能力,所以铜离子先放电;氢氧根离子的放电能力大于硝酸根离子的放电能力,所以氢氧根离子先放电.阳极上失电子,发生氧化反应,所以氢氧根离子在阳极上失电子生成氧气:4OH--4e-=O2+2H2O;阴极上得电子,反应还原反应,所以铜离子的阴极上得电子生成铜:Cu2++2e-=Cu,
故答案为:4OH--4e-=O2+2H2O.
| ||
| 加热 |
| ||
| 加热 |
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
根据盖斯定律(①+②)×
| 1 |
| 2 |
(3)燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,总反应:4NH3+3O2
| ||
4NH3+12OH--12e=2N2+12H2O,故答案为:负极;4NH3+12OH--12e=2N2+12H2O;
(4)Cu(NO3)2溶液中铜离子的放电能力大于氢离子的放电能力,所以铜离子先放电;氢氧根离子的放电能力大于硝酸根离子的放电能力,所以氢氧根离子先放电.阳极上失电子,发生氧化反应,所以氢氧根离子在阳极上失电子生成氧气:4OH--4e-=O2+2H2O;阴极上得电子,反应还原反应,所以铜离子的阴极上得电子生成铜:Cu2++2e-=Cu,
故答案为:4OH--4e-=O2+2H2O.
点评:本题主要考查了热化学方程式的书写、电极反应的书写,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目


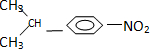
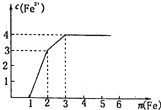 (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )