题目内容
18.标准状况下有下列对这四种气体的关系从小到大表示不正确的是( )①6.72L甲烷 ②3.01×1023个氯化氢分子 ③13.6g硫化氢
④0.2mol NH3.
| A. | 体积:④<①<②<③ | B. | 密度:①<④<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子数:②<④<③<① |
分析 标况下,气体摩尔体积相等,甲烷的物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(HCl)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,
n(H2S)=$\frac{13.6g}{34g/mol}$=0.4mol,0.2molNH3,
A.根据V=nVm知,其体积大小与物质的量成正比;
B.根据ρ=$\frac{M}{{V}_{m}}$知,气体密度与摩尔质量成正比;
C.根据m=nM计算其质量;
D.根据N=nNA计算其分子个数,再结合分子构成计算H原子个数.
解答 解:标况下,气体摩尔体积相等,甲烷的物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(HCl)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,n(H2S)=$\frac{13.6g}{34g/mol}$=0.4mol,0.2molNH3,
A.根据V=nVm知,其体积大小与物质的量成正比,所以其体积从小到大顺序是:④<①<③<②,故A错误;
B.根据ρ=$\frac{M}{{V}_{m}}$知,气体密度与摩尔质量成正比,甲烷摩尔质量是16g/mol、HCl摩尔质量是36.5g/mol、硫化氢摩尔质量是34g/mol、氨气摩尔质量为17g/mol,所以其密度顺序为:①<④<③<②,故B正确;
C.甲烷质量=16g/mol×0.3mol=4.8g,硫化氢质量为13.6g,HCl质量=0.5mol×36.5g/mol=18.25g,氨气质量=0.2mol×17g/mol=3.4g,所以其质量顺序为:④<①<③<②,故C正确;
D.根据N=nNA知,其分子个数之比等于其物质的量之比,甲烷中H原子个数为1.2NA,HCl中H原子个数为0.5NA,硫化氢中H原子个数为0.8NA,氨气中H原子个数为0.6NA,所以氢原子数:②<④<③<①,故D正确;
故选A.
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| A. | A<B<C<D | B. | D<A<B=C | C. | A=D<B=C | D. | D<A<B<C |
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
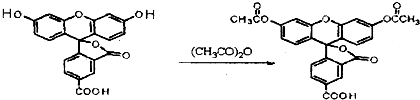
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
| A. | 5-FAM转变为5-CFDA属于取代反应 | |
| B. | 实验室鉴别5-FAM与5-CFDA可用碳酸氢钠溶液 | |
| C. | 5-FAM的分子式为:C21H3O7 | |
| D. | 5-FAM和5-CFDA分子中的所有原子均共面 |
①
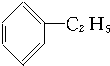 ②
②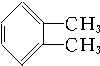 ③
③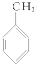 ④
④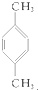
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
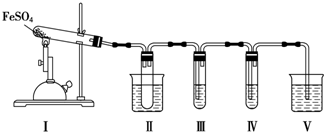
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.