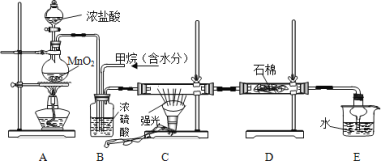
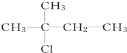
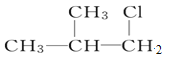
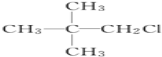
题目内容
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数:
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5
CH3COO-+H+ K1=1.75×10-5
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10
CH3COOH+OH- K2=5.71×10-10
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.对混合溶液进行加热,K1增大、K2减小
B.混合溶液的pH>7
C.混合溶液中c(CH3COO-)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
【答案】C
【解析】
A. 电离、水解均为吸热反应,所以对混合溶液进行微热,K1增大、K2增大,故A错误;
B. 由K的关系可知,醋酸和醋酸钠的混合溶液中,电离程度大于水解水解程度,溶液显酸性pH<7,故B错误;
C. 根据醋酸和醋酸钠的混合溶液中,电离程度大于水解程度,所以混合溶液中c(CH3COO)>c(Na+),故C正确;
D. 温度不变,若在混合溶液中加入少量NaOH固体,促电离抑水解c(CH3COO)增大,故D错误;
故选C。

【题目】最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是_______
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为_______,其pH=______。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)![]() 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g)![]() 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g)![]() CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数_________。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式_______________。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
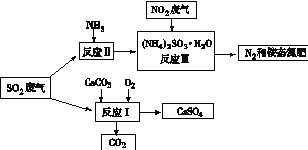
①写出反应Ⅰ的化学方程式:________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是___________。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是________________。
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。