题目内容
反应2A(g) 2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
 A.升温 B.增大反应器的体积 C.增大c(A) D.降温
A.升温 B.增大反应器的体积 C.增大c(A) D.降温
 2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( ) A.升温 B.增大反应器的体积 C.增大c(A) D.降温
A.升温 B.增大反应器的体积 C.增大c(A) D.降温B
略

练习册系列答案
相关题目
 3C(g) +
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。 CO2(g) + H2(g),在密闭容器达到平衡。当温度为749K时,K= 1,当CO的起始浓度为2 mol·L-1,H2O的起始浓度为6mol·L-1时,则CO的转化率为
CO2(g) + H2(g),在密闭容器达到平衡。当温度为749K时,K= 1,当CO的起始浓度为2 mol·L-1,H2O的起始浓度为6mol·L-1时,则CO的转化率为 nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线 上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是 ( )
上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是 ( )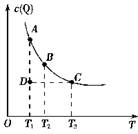
 〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是:
〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是: H2(g)+I2(g)]时,I2的体积分数为X%;相同条件下,2 mol HI分解达平衡时,I2的体积分数为Y%,则X与Y的关系为
H2(g)+I2(g)]时,I2的体积分数为X%;相同条件下,2 mol HI分解达平衡时,I2的体积分数为Y%,则X与Y的关系为 pC(g)+qD(g);△H<0 。下列结论中不正确的是
pC(g)+qD(g);△H<0 。下列结论中不正确的是 和
和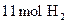 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应

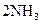 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答: 的转化率.
的转化率. 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.