题目内容
(1)49g硫酸的物质的量为______mol,若在水中完全电离可产生______molH+,______molSO42-.若有一定量的硫酸完全电离产生1.806×1024个H+,此硫酸的质量为______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是______,相对分子质量为______; 等物质的量的NH3与H2S质量比为______; 1.7g氨气与______mol H2O含有的电子数相等.
解:(1)49g硫酸的物质的量为n= =
=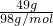 =0.5mol,
=0.5mol,
硫酸为二元酸,则在水中完全电离产生的H+的物质的量为0.5mol×2=1mol,
49g硫酸中,n(SO42-)=0.5mol,
1.806×1024个H+的物质的量为:n(H+)= =
=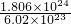 =3mol,
=3mol,
则:n(H2SO4)= ×n(H+)=
×n(H+)= ×3mol=1.5mol,
×3mol=1.5mol,
m(H2SO4)=1.5mol×98g/mol=147g,
故答案为:0.5;1;0.5;147g.
(2)标准状况下,11.2L的H2S的物质的量为n=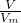 =
=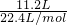 =0.5mol,而质量为17g,
=0.5mol,而质量为17g,
则:M(H2S)=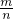 =
= =34g/mol,
=34g/mol,
物质的摩尔质量与相对分子质量在数值上相等,则为17,
根据n= 可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2,
可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2,
1.7g氨气的物质的量为: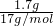 =0.1mol,
=0.1mol,
含电子的物质的量为:0.1mol×(7+3×1)=1mol,
则水含有的电子的物质的量也为1mol,一个水分子含有的电子数为(2×1+8)
所以水的物质的量为 =0.1mol,
=0.1mol,
故答案为:34g/mol;34;1:2;0.1mol.
分析:(1)根据n= =
= ,结合物质的分子组成计算离子的物质的量和浓度;
,结合物质的分子组成计算离子的物质的量和浓度;
(2)根据n=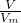 =
= ,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算.
,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算.
点评:本题考查物质的量的计算,题目难度不大,注意有关计算公式的运用和物质的结构和组成.
 =
=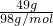 =0.5mol,
=0.5mol,硫酸为二元酸,则在水中完全电离产生的H+的物质的量为0.5mol×2=1mol,
49g硫酸中,n(SO42-)=0.5mol,
1.806×1024个H+的物质的量为:n(H+)=
 =
=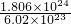 =3mol,
=3mol,则:n(H2SO4)=
 ×n(H+)=
×n(H+)= ×3mol=1.5mol,
×3mol=1.5mol,m(H2SO4)=1.5mol×98g/mol=147g,
故答案为:0.5;1;0.5;147g.
(2)标准状况下,11.2L的H2S的物质的量为n=
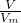 =
=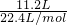 =0.5mol,而质量为17g,
=0.5mol,而质量为17g,则:M(H2S)=
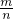 =
= =34g/mol,
=34g/mol,物质的摩尔质量与相对分子质量在数值上相等,则为17,
根据n=
 可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2,
可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2,1.7g氨气的物质的量为:
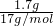 =0.1mol,
=0.1mol,含电子的物质的量为:0.1mol×(7+3×1)=1mol,
则水含有的电子的物质的量也为1mol,一个水分子含有的电子数为(2×1+8)
所以水的物质的量为
 =0.1mol,
=0.1mol,故答案为:34g/mol;34;1:2;0.1mol.
分析:(1)根据n=
 =
= ,结合物质的分子组成计算离子的物质的量和浓度;
,结合物质的分子组成计算离子的物质的量和浓度;(2)根据n=
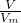 =
= ,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算.
,结合摩尔质量与相对分子质量的关系以及分子的组成原子的原子结构计算.点评:本题考查物质的量的计算,题目难度不大,注意有关计算公式的运用和物质的结构和组成.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目