题目内容
17.实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液、水 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Br2和CCl4混合物不分层;
B.葡萄糖含-CHO,具有还原性,而蔗糖不具有;
C.锌粒、稀HNO3反应生成NO,不生成氢气;
D.中和滴定实验,需要胶头滴管滴加指示剂.
解答 解:A.Br2和CCl4混合物不分层,不能利用分液漏斗分离,应选蒸馏装置及相应仪器分离,故A错误;
B.葡萄糖含-CHO,具有还原性,而蔗糖不具有,则选银氨溶液后水浴加热,需要仪器为试管、烧杯、酒精灯,产生银镜的为葡萄糖,故B正确;
C.锌粒、稀HNO3反应生成NO,不生成氢气,制备氢气应选稀硫酸,故C错误;
D.中和滴定实验,需要胶头滴管滴加指示剂,则仪器缺少胶头滴管,试剂缺酸碱指示剂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质检验、气体的制备及中和滴定实验等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
16.在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )
| A. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 该反应中化学能全部转化为热能 |
8.如图有关图示分析正确的是( )
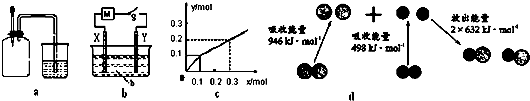

| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| C. | 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,其热化学方程式为 N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
5.己烯雌酚[C18H20O2]的结构简式如图所示,下列有关叙述中不正确的是( )
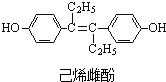

| A. | 与NaOH反应可生成化学式为C18H18O2Na2的化合物 | |
| B. | 聚己烯雌酚含有顺式和反式两种结构 | |
| C. | 1mol己烯雌酚最多可与7molH2发生加成反应 | |
| D. | 形成高分子 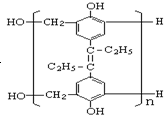 的单体中有己烯雌酚 的单体中有己烯雌酚 |
12.关于下列各装置图的叙述不正确的是( )
| A. |  用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 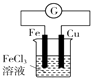 装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 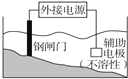 装置中钢闸门应与外接电源的负极相连 | |
| D. | 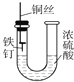 装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
2.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
9.A、B、C、D、E是原子序数依次增大的短周期主族元素.A是电子数等于电子层数的非金属,B是地壳中含量最多的元素,C的族序数比A的族序数大1,D的次外层电子数等于最内层电子数和最外层电子数之和.下列叙述中正确的是( )
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
6.已知某种气态化石燃料只含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体(包括水)全部通入如图所示的装置,得到如表所示的实验数据(左侧U形管中干燥剂至吸收水蒸气且假设产生的气体完全被吸收,忽略澄清石灰水中的水分损失)
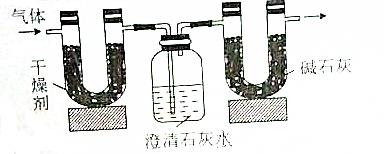
根据实验数据回答下列问题:
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.

| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 51.10g | 52.45g |
| (澄清石灰水+广口瓶)的质量 | 408.00g | 410.20 |
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.
7.下列说法正确的是( )
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |