题目内容
15.下列元素第一电离能最大的是( )| A. | 2p轨道上有3个不成对电子的元素 | |
| B. | 最外层电子数是次外层电子数的3倍的元素 | |
| C. | 形成化合物种类最多的元素 | |
| D. | 周期数等于族序数等于次外层电子数的元素 |
分析 气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能,原子越难失电子,第一电离能越大;同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
A.2p轨道上有3个不成对电子的元素,为N元素或P元素;
B.最外层电子数是次外层电子数的3倍的元素为氧元素;
C.形成化合物种类最多的元素为碳元素;
D.电子层数=周期数,主族序数=最外层电子数,周期数等于族序数等于次外层电子数的元素,即电子层数=次外层电子数的元素=最外层电子数.
解答 解:A.2p轨道上有3个不成对电子为短周期元素,短周期元素的p轨道上有3个未成对电子,则元素原子的核外电子排布为1s22s22p3或1s22s22p63s23p3,故为N元素或P元素;
B.原子的最外层电子数是次外层电子数的3倍,原子核外应有2个电子层,最外层电子数为6,为O元素,
C.在已经发现的3000多万种物质中,有机物占90%以上,有机物是含有碳元素的化合物,所以形成化合物种类最多的元素为碳元素;
D.原子结构中,电子层数=周期数,主族序数=最外层电子数,则周期数等于族序数等于次外层电子数的元素,为铍元素;
元素Be、C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C>Be,同一主族元素的第一电离能随着原子序数的增大而减小,N>P,所以元素第一电离能最大的选A,
故选A.
点评 本题考查了第一电离能大小的判断,难度中等,根据元素周期律来分析解答即可,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.

| 化合物/选项 | A | B | C | D |
| Y | H2O | Fe2O3 | C2H5OH | FeCl3 |
| W | Fe3O4 | Al2O3 | C2H5ONa | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NH3是极性分子,其空间构型为平面正三角形 | |
| B. | CCl4是非极性分子,其中的C-Cl键为极性共价键 | |
| C. | CO2 是非极性分子,据相似相溶原理,它易溶于水中 | |
| D. | BF3是极性分子,其中心原子的杂化轨道类型为sp2杂化 |
| A. | 是氢的一种新的同素异形体 | B. | 是氢的一种新的同位素 | ||
| C. | 它的组成可用H${\;}_{3}^{+}$表示 | D. | 它的化学性质与氢气相似 |
| A. | CH4、C2H4燃烧生成水的质量相同,消耗氧气不同 | |
| B. | C2H4燃烧生成水与CO2的物质的量相等 | |
| C. | CH4含氢量最高,燃烧生成水最多 | |
| D. | C2H2含碳量最高,燃烧生成的CO2最多 |
 ;
;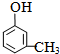 ;
; 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O). B.
B.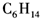 C.
C.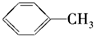 D.
D.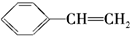
 ,该分子也是生产某塑料的单体,写出合成该塑料的化学方程式:
,该分子也是生产某塑料的单体,写出合成该塑料的化学方程式: .
.